서 언
재료 및 방법
실험 재료
단백질 추출 및 이차원 전기영동
MALDI-TOF/TOF MS의 분석
결과 및 고찰
단백질체의 전개 및 번호의 부여
발현된 단백질체의 동정
동정된 Proteome의 생리적 기능 분석
서 언
단백질체(proteome)는 특정 조건 하에서 특정 시간에 유기체의 세포, 소기관, 조직 또는 개체레벨에서 발현되는 단백질 전체를 의미한다(Eldakak et al., 2013). 일반적으로 세포는 생존을 위해 구성, 생리 및 생화학적 기능을 수행하는 다수의 단백질들을 포함하고 있으며 단백질체는 이러한 과정을 조절하는 단백질의 발현을 반영하기 때문에, 그에 대한 정보는 세포 내의 생명현상에 대한 올바른 이해를 위해 매우 중요하다고 할 수 있다(Esteve et al., 2013).
사과(Malus domestica Borkh.)는 세계에서 가장 널리 재배되고 있는 목본류 과수 중 하나로 10,000개가 넘는 품종이 있어 그 특성이 매우 다양하지만, 현재는 몇몇 주요 품종이 세계 전체 생산량의 대부분을 차지하고 있다(Janick et al., 1996). 사과 단백질체에 대한 체계적인 분석은 이탈리아의 남부 지역 품종인 ‘Annurca’ 사과(M. domestica Borkh. cv. Annurca)의 3계통들에서 추출된 단백질을 이용하여 수행되었다(Guarino et al., 2007). 이차원전기영동(2-dimensional electrophoresis, 2-DE) 결과 3계통들에서 203개의 단백질 spot이 공통적으로 발현되었으며, 그 중 39개를 mass spectrometry(MS)를 이용하여 분석한 결과, 해당 단백질들은 대사, 에너지, 스트레스, 과실의 숙성 및 알러지 등과 같은 기능적 카테고리에 속하는 것으로 밝혀졌다. 사과의 성숙과 관련하여 미토콘드리아 단백질의 발현을 분석한 결과, 트리카르복실화산 경로, 전자전달계, 탄소대사 및 세포막 수송과정에서 작용하는 효소들이 변화하는 것으로 나타났는데, 그 중 미토콘드리아 Mn-SOD의 차등적인 발현 및 carbonyl화된 산화 단백질의 증가는 활성산소종(reactive oxygen species, ROS)의 대사가 과일 성숙에 관여한다는 것을 시사하였다(Qin et al., 2009). 한편 사과 과실의 성숙도와 수확 후 품질을 평가하는데 있어서 매우 중요한 요소인 경도는 과일의 성숙과 더불어 감소한다(Peng and Lu, 2007). 저장성이 다른 사과 품종들의 단백질체를 2-DE로 전개하여 비교한 결과 총 36개의 단백질 spot들이 차등적으로 발현되었으며, 이 spot들을 matrix assisted laser desorption/ionization-time of flight (MALDI-TOF) MS로 분석하고 malus expressed sequence tags(EST) database에서 조사한 결과, 높은 저장성을 갖는 품종에서는 에틸렌 생합성 관련 단백질의 발현량이 적은 것으로 나타났다(Marondedze and Thomas, 2012). 항산화에 관여하는 다수의 단백질들도 과일의 성숙과 더불어 증가하였는데, 이는 사과의 성숙이 산화적 스트레스와 관련되어 있음을 시사하였다. 또한 사과 및 키위의 여러 성숙 단계들에서 실시된 단백질체 연구 결과, 에틸렌 생산, 항산화 및 산화·환원, 탄수화물 대사, 산화적 스트레스, 에너지 생산 및 방어 반응에 관련된 다수의 단백질들이 성숙의 진행과 더불어 양적으로 증가하는 것으로 나타났다(Zheng et al., 2013; Shin et al., 2020).
사과는 여러 가지 식물 유래 식품과 더불어 심장병, 뇌졸중 및 일부 암과 같은 만성 질병의 위험을 줄임으로써 인간 건강에 긍정적인 영향을 미친다(van’t Veer et al., 2000; Boyer and Liu, 2004). 그러나 사과 섭취는 민감한 사람에게는 심각한 알러지 위험을 초래할 수 있다. 사과에는 (i) 17.5kDa의 분자량을 갖는 Bet v 1과 상동성인 Mal d 1(pathogenesis-related protein; PRP-10), (ii) 23kDa의 분자 질량을 갖는 thaumatin-like protein(TLP)인 Mal d 2(PRP-5), (iii) 9kDa의 분자량을 갖는 lipid transfer protein(LTP)인 Mal d 3(PRP-14) 및 (iv) 14kDa의 분자량을 갖는 Bet v 2와 상동성인 Mal d 4(profilin) 등 네 가지 주요 알러지원들이 있는 것으로 알려졌다(Herndl et al., 2007). 사과의 단백질체 분석 결과 심한 알러지 반응을 일으키는 비특이적 지질 단백질인 Mal d 3는 주로 과피에 함유되어 있으나, 경미한 증상을 유발하는 Mal d 1은 과육에 함유되어 있는 것으로 알려졌다(Marzban et al., 2005). 사과를 장기간 저장시에는 Mal d 3 수준은 감소하였으나(Sancho et al. 2006a), Mal d 1은 오히려 증가하는 것으로 보고되었다(Sancho et al., 2006b). 또한 western blot의 결과 사과의 수용성 분획 중의 단백질에서는 Mal d 1, Mal d 2, Mal d 3 및 Mal d 4가 존재하는 것이 밝혀졌고, 그것들은 다른 증상을 나타내는 알러지 환자들의 혈청에 의해 인식된 단백질들과도 일치하였다(Herndl et al., 2007).
본 연구에 이용된 ‘홍로’는 국내에서 육성된 최초의 사과품종으로 국립원예특작과학원에서 1980년 ‘스퍼어리 브레이즈’에 ‘스퍼 골든 딜리셔스’를 교배하여 육성되었으며, 1988년에 최종 선발·명명되었다. 국내에서 재배되고 있는 과일 중 사과는 생산액 대비 1위인 25% 이상을 차지하고 있는 중요 과실이나 현재까지 우리나라에서 사과와 관련된 체계적인 단백질체 분석에 대한 연구는 아직 보고된 바 없다. 그러므로, 본 연구는 수확기 사과 과피에서 발현되는 단백질체의 전체상과 발현 정도를 파악하고 생리적 역할과의 관련성을 구명하여 추후 사과의 단백질체 연구를 위한 좌표로 삼기 위해 수행되었다. 실험재료는 우리나라에서 육성된 사과 품종인 ‘홍로’를 이용하였으며 연구는 2-DE와 질량분석기술을 기반으로 수행되었다.
재료 및 방법
실험 재료
사과는 2014년 8월 26일 경남 거창의 사과이용연구소의 포장에 있는 ‘홍로’의 나무로부터 적정의 성숙 상태에 이른 과일을 1반복당 3개씩/주 3주에서 9개를 수확하였으며, 3반복으로 실시하였다. 수확된 과일은 당일에 수도물로 세정한 후 과피 박리용 칼로 두께가 1mm 이하가 되도록 유의하며 과피를 박리하였다. 박리된 과피는 즉시 액체 질소로 동결한 후 유발에서 미세한 분말로 마쇄하여 ‑ 70°C에 보관하고, 이후의 단백질 추출에 사용하였다.
단백질 추출 및 이차원 전기영동
단백질은 약간의 수정이 가해진 페놀법으로 추출되었다(Hurkman and Tanaka, 1986). 액체 질소로 마쇄되어 ‑ 70°C에 보관되어 있던 과피 20mL를 50mL의 tube에 분주한 후 20mL의 ice-cold extraction buffer(EB)[0.5M Tris, pH 8.8, 0.7M sucrose, 50mM EDTA, 0.1M KCl, 2%(V/V) 2-mercaptoethanol 및 2 mM PMSF(in methanol)]를 첨가하여 단백질을 추출하였다. 100mM ammonium acetate(in 100% methanol) 및 80% acetone으로 세정된 단백질은 공기중에서 적당한 정도로 건조된 후, 0.45µm membrane filterated lysis buffer(9M urea, 2% CHAPS, 50mM DTT 및 0.2% Biolyte, pH 3 ‑ 10)를 적당량 첨가하여 용해하였다. 단백질의 농도는 lysis buffer만이 첨가된 것을 대조구로 하여 Cummasi Briallant blue G(CBBG) 법으로 정량하였으며(Bradford, 1976), 2-DE를 위해 400µg으로 분주되었다. Lysis buffer에 용해된 단백질 시료에는 적당량의 filterated rehydration buffer(9M urea, 2% CHAPS, 50mM DTT 및 0.2% Biolyte, pH 3 ‑ 10 및 미량의 brome phenol blue)로 400µg의 단백질 시료를 300µL가 되게 mess up하였으며, 전기영동 시까지 ‑ 20°C에 보관하였다.
이차원 전기영동은 약간의 수정이 가해진 Lee et al.(2012)의 방법에 따라 실시되었다. 등전점(isoelectronic-focusing, IEF) 전기영동은 17cm immobilized pH gradient gel(IPG) strip(pH 4 ‑ 7과 pH 5 ‑ 8 범위, Bio-rad, CA, USA)에 단백질을 로딩하고 PROTEIN i12 IEF cell(BioRad, Hercules, CA, USA)에 장착하여 50V의 조건에서 12시간 동안 재수화를 시킨 후, rapid ramping mode로 3시간에 걸쳐 10,000V까지 전압을 상승시키고 다시 10,000V에서 6시간 동안 focusing을 하였다. IEF 종료 후 equilibration solution 1(6 M urea, 2% SDS, 375mM Tris-HCl, pH 8.8, 20% glycerol, 미량의 BPB, 130mM DTT)과 equilibration solution 2(6M urea, 2% SDS, 375mM Tris-HCl, pH 8.8, 20% glycerol, 미량의 BPB, 135mM iodoacetamide)로 gel strip의 reduction과 alkylation을 각각 실시하였다. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)는 SDS-polyacrylamide gel mixture(30% acrylamide/0.8% bis-acrylamide, 0.1% SDS, 1.5M Tris-HCl, pH 8.8, TEMED 및 10% APS)로 조제된 11.5%의 SDS-PAGE gel(20에 IEF가 종료된 pH 4 ‑ 7과 pH 5 ‑ 8의 strip gel을 loading하고, SDS-PAGE buffer(25mM tris base, 192mM glycine 및 0.1%의 SDS)로 채워진 PROTEIN Ⅱ xi 2-D cell(BioRad, Hercules, CA, USA)에서 실시하였다. SDS-PAGE가 종료된 gel은 CBBG-250(Bio-rad, CA)을 이용하여 염색하고(Matsui et al., 1999), GS-800 Calibrated Densitometer(Bio-Rad, Hercules, CA, USA)로 scanning하여 gel image를 획득하였으며, PDQuest software(version version 7.2.0, Bio-Rad)를 사용하여 분석하였다. 모든 2-DE 분석은 반복 당 각각 2회씩 독립적으로 추출된 단백질 시료들을 이용하여 6회에 걸쳐 실시되었으며(3반복×2회=6회), 고화질의 이미지를 갖는 gel을 선택하여 master gel로 사용하였다. 각 단백질 spot들의 abundance value(AV)는 해당 SDS-PAGE gel의 배경 대비 spot의 상대적인 값으로 측정되었며, 6회 측정의 평균값이 비교되었다. SDS-PAGE gel에서 pI 범위의 확장을 위해 pI 4 ‑ 7의 gel image로부터 pI 4 ‑ 5의 영역을 절단한 후 pI 5 ‑ 8의 image에 더하여 pI 4 ‑ 8 범위의 합성 이미지를 작성하였다. 합성된 gel image는 pI 값과 분자량에 따라 상·하 6개의 영역으로 구분되었으며, 각각의 영역에서는 반복적으로 일관되게 발현되는 protein spot들이 pI 값과 분자량에 따라 식별이 가능하도록 고유 번호를 부여하였다.
MALDI-TOF/TOF MS의 분석
MALDI-TOF/TOF MS의 분석을 위한 전처리는 수정된 Kwon et al.(2016)의 방법에 따라 실시되었다. 단백질 spot들은 CBBG로 염색된 gel로부터 직경 1mm 이하의 크기로 coring되어 fixing solution(30% ethanol 및 2% phosphoric acid), acetonitrile(ACN) 및 ammonium bicarbonate(ABC)로 탈색과정을 거친 후 동결·건조하였다. 단백질 spot들은 10mM dithiotheritol(DTT)/0.1M ABC와 55mM iodoacetamide/0.1M ABC로 각각 reduction과 alkylation을 시킨 후, trypsin이 포함된 buffer(50ng trypsin/µL의 25mM ABC 및 0.1% octalglucopyronoside solution)를 첨가하고 in gel digestion을 하였다. Trypsin에 의해 절단된 단백질 spot들의 peptide는 extraction solution [acetonitrile(ACN):3rd distilled water(DW): trifluoroacetic acid(TFA)=66:33:0.1]을 첨가하여 추출하고 동결·건조시켰다.
단백질의 동정을 위해 peptide에 소량의 sample solution(50% ACN 및 0.1% TFA)을 첨가하여 용해시키고 matrix solution[5mg의 α-cyano-4-hydroxy-cinnamic acid(CHCA)/1mL의 sample solution]을 동량 첨가하여 신속하게 pippet mix한 후, MALDI-TOF/TOF MS 분석용 plate에 loading하여 분석을 개시하였다(Kwon et al., 2016). Peptide의 MS와 MS/MS 분석은 ABI 4800 Plus TOF-TOF Mass Spectrometer(Applied Biosystems, Framingham, MA, USA)로 수행되었다. TOF-TOF MS 분석은 200Hz ND, 355nm YAG laser operation, 25 이상의 signal/noise 비율 및 1kv mode의 1,000 ‑ 1,250 연속 laser 노출 조건 하에서 10개의 higher intense ion들에 대하여 실시되었다. MS와 MS/MS spectra data는 100ppm의 mass tolerance에서 UniProt database(version 20131104; 30 938 908 sequences) 및 Protein Pilot V.3.0 database를 사용하여 분석되었다. Database에서 MS/MS 스펙트럼 검색을 위해 single missing pick, methionine의 oxidation 및 cysteine의 carbamidomethylation이 허용되었다. 각각의 peptide ion score 들은 p=0.05의 통계적인 유의성 한계치를 사용하여 검색되었다. 동정된 단백질들의 gene ontology(GO) 분석은 TAIR(http://www.arabidopsis.org/), UniProtKB(http://www.uniprot.org/), KEGG(http://www.genome.jp/kegg/) 및 PIR(http://pir.georgetown.edu/) 데이터베이스를 사용하여 수행되었으며, 그들의 GO 범주에 기초하여 각각의 생리·생화학적 기능 또는 세포 성분의 요소들로 구분되었다.
결과 및 고찰
단백질체의 전개 및 번호의 부여
우리나라에서 재배되고 있는 사과 ‘홍로’ 과실에서 발현되는 단백질체의 전체상을 구명하기 위해 정밀하고 반복성이 높은 방법으로 이차원 전기영동을 실시하였다. pI 범위가 다른 strip gel을 이용하여 IEF 전기영동를 한 후 SDS-PAGE를 실시한 결과, 대부분의 단백질들은 pI 값 4 ‑ 8의 범위 내에서 분포하는 것으로 나타났다(Fig. 1). pI 값 4 ‑ 7과 5 ‑ 8 범위의 IEF gel들에서 발현된 단백질 spot들을 비교한 결과 두 gel들의 공통 영역인 pI 값 5 ‑ 7범위의 spot들은 발현 정도가 동일하였음으로(결과 미제시), pI 값 4 ‑ 7의 gel의 이미지에서 4 ‑ 5 영역을 절단하고 pI 값 5 ‑ 8의 gel 이미지에 더하여 pI 값 4 ‑ 8 범위에 존재하는 spot들의 합성된 이미지를 작성하였다. 반복된 6번의 실험에서 pI 값 4 ‑ 8의 범위에 걸쳐 발현된 spot들 중 일관되고 유사한 정도로 발현된 502개의 spot들에 번호를 부여하였다. Gel 내의 spot들은 pI 값과 분자량에 따라 상·하 3개씩 6개의 영역으로 분할하였으며, pI 값이 낮고 분자량은 높은 순서로부터 pI 값이 높고 분자량이 낮은 순서로 각각의 고유 번호를 부여하였다.
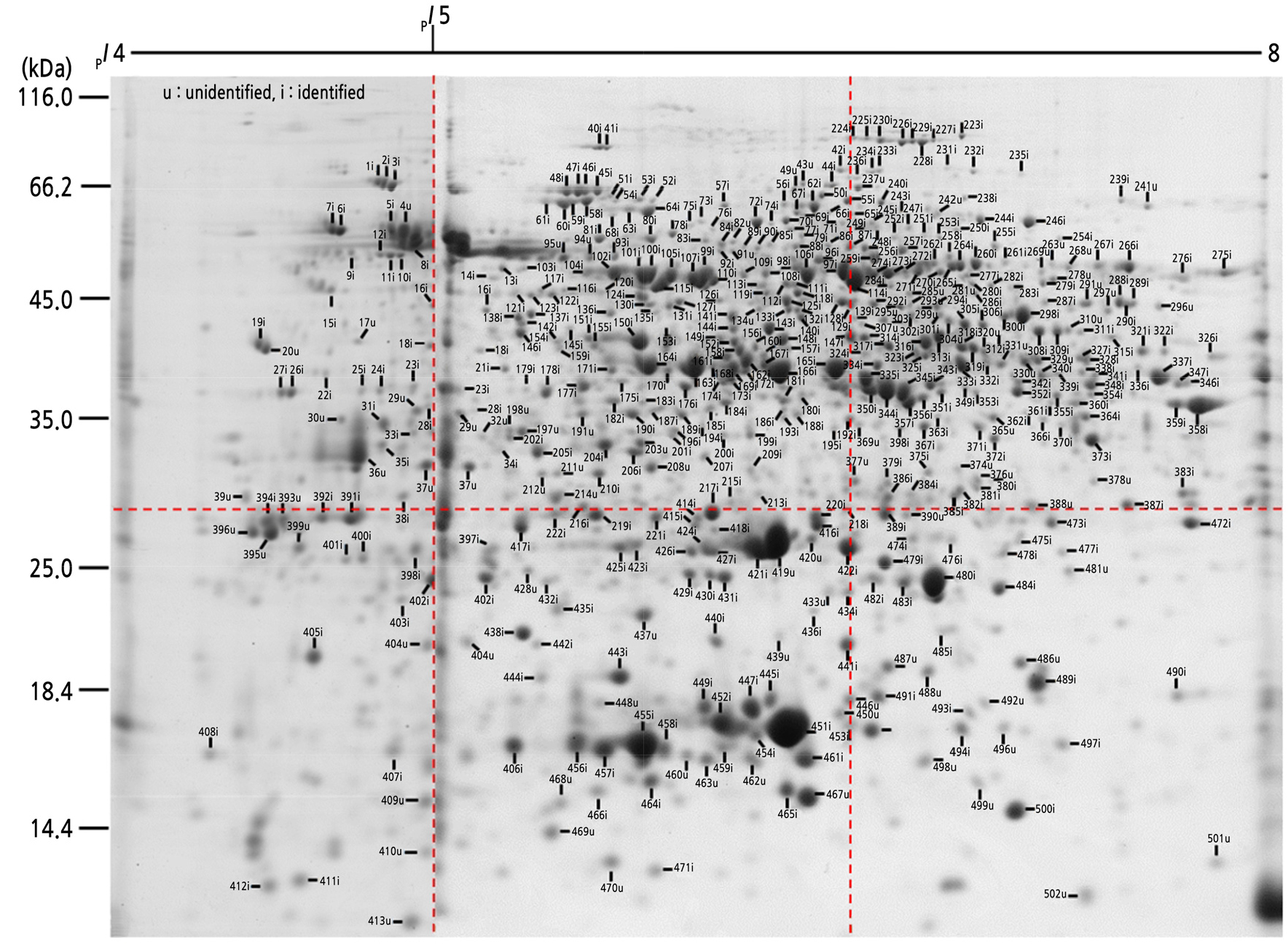
Fig. 1
Synthetic 2-DE image of the peel of Malus domestica ‘Hong-ro’. A total of 400 µg of protein extracted from the peel was loaded onto each IPG strips (17 cm, pH 4 ‑ 7 and 5 ‑ 8) and separated by 11.5 % SDS-PAGE. The gels were stained with colloidal CBB. The pI 4 ‑ 5 portion (A and D) of the pI 4 ‑ 7 gel image was cut and added to the pI 5 ‑ 8 gel image (B, C, E and F).
발현된 단백질체의 동정
‘홍로’ 과피에서 발현된 502개의 단백질 spot들을 MALDI-TOF/TOF로 분석한 결과, 408개의 spot들이 각각의 기능을 갖는 단백질들로 동정되었으며, 5개의 spot들은 기능이 구명되지 않은 단백질들로 동정되었고, 89개의 spot들은 미동정되었다(Suppl. Table 1s). 분석된 502개 spot들의 발현 정도를 나타내는 abundance value(AV)의 합계는 665.09(±73.69)로 나타났다. 동정된 408개의 단백질들을 생물학적 기능별로 정리한 결과, carbohydrate metabolism에 속하는 것들이 87개로 가장 많았으며(AV 합계 120.97, 전체 AV의 합계 665.09의 18.2%), 그 다음은 protein metabolism 59개(AV 합계 72.08, 10.8%), protein folding 37개(AV 합계 34.12, 5.1%), defense 및 stress response 35개(AV 합계 56.95, 8.6%), protein degradation 33개(AV 합계 28.87, 4.3%), antioxidant enzyme 29개(AV 합계 41.58, 6.3%), secondary metabolite metabolism 16개(AV 합계 16.4, 2.5%), lipid metabolism 16개(AV 합계 8.89, 1.3%), transport 15개(AV 합계 8.75, 1.3%), cytoskeleton constitution 14개(AV 합계 12.89, 1.9%), allergy 12개(AV 합계 104.55, 15.7%), nucleotide metabolism 11개(AV 합계 10.83, 1.6%) 및 ATP synthesis 10개(AV 합계 18.46, 2.8%) 등의 순이었다(Fig. 2 and Suppl. Table 2s). 또한 다량으로 발현된 단백질 spot들 가운데 AV 1위는 spot 451번인 major allergen Mal d 1(AV 54.42), 2위는 spot 419번 unidentified protein(AV 28.40), 3위는 spot 455번 MLP-like protein(AV 24.08), 4위는 spot 480번 glutathione S-transferase(AV 18.61), 5위는 spot 166번 glutamine cytosolic isozyme(AV 13.26), 6위는 spot 421번 L-ascorbate peroxidase(AV 12.67), 7위는 spot 163번 β-cyanoalanine synthase(AV 10.81), 8위는 spot 114번 enolase-like(AV 10.48), 9위는 spot 36번 unidentified(AV 10.16), 10위는 spot 452번 major allergen Mal d 1(AV 8.80)이었다(Suppl. Table 1s). 상기 10대 단백질 spot들의 AV의 합계는 191.69로 과피에서 발현된 전체 단백질체의 약 28.8%를 차지하였다. 그 중에서도 발현량 1, 3 및 10위인 spot 451, spot 452 및 spot 455번의 대량으로 발현된 단백질들은 알레르기에 관련된 것들이었다. 또한 알레르기에 관련된 것으로 동정된 단백질들은 총 12개에 불과하였으나, AV의 합계는 2위에 달하였다. 따라서 사과 과피에서는 알레르기 관련 단백질들이 소수이지만 매우 대량으로 발현되는 것으로 판단되었다.
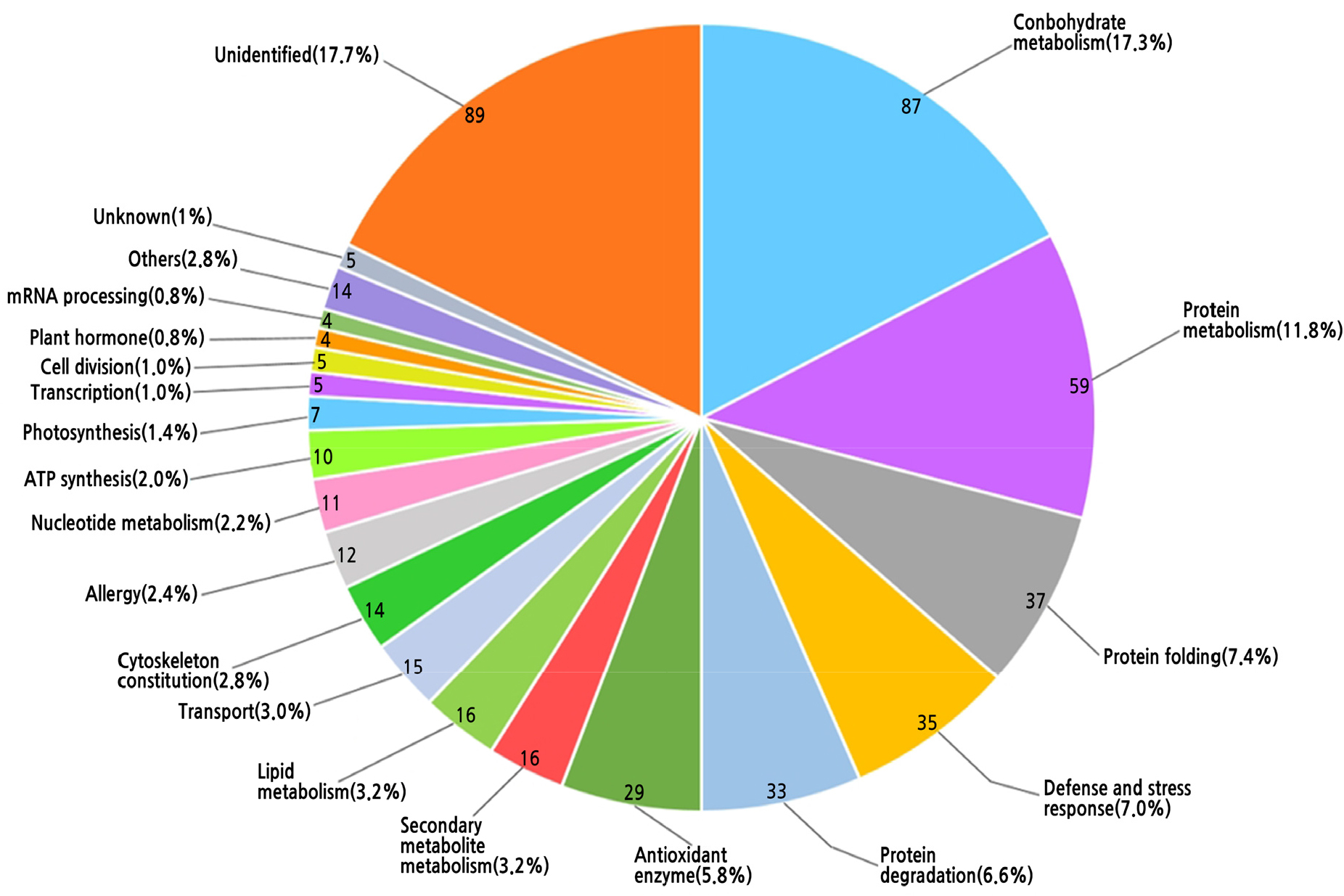
Fig. 2
Classification of the biological functions of proteins expressed in the peel of Malus domestica ‘Hong-ro’. Identified proteins were classified and presented according to the biological process. The percentage distributions of the Gene Ontology (GO) terms were determined using the iProClassGO tool in the Protein Information Resource (PIR) database. The total number of the spots analyzed was 502.
동정된 Proteome의 생리적 기능 분석
동정된 단백질들 중 2.0 이상의 AV 값을 갖는 단백질들은 합계 63개였으며, 각각의 기능을 TAIR, UniProtKB, KEEG 및 PIR database에서 조사하고 분류하였다(Suppl. Table 2s and Fig. 3).
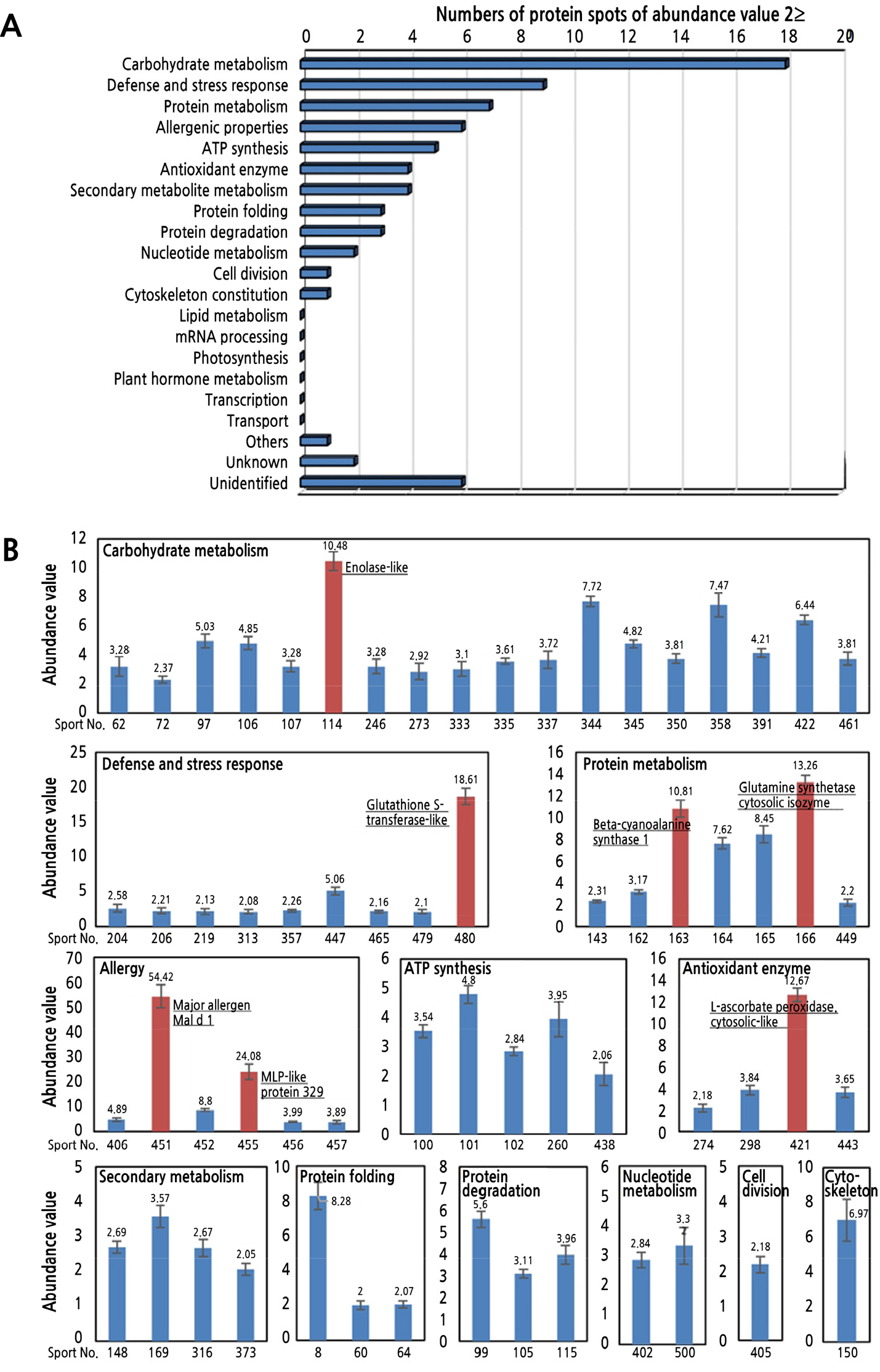
Fig. 3
Numbers of biological functional groups of proteins expressed by abundance value ≥2 in the peel of Malus domestica ‘Hong-ro’. Numbers of proteins spots by abundance value ≥ 2 in the biological functional group (A). Expression levels of the proteins in the biological functional group by abundance value ≥ 2 (B).
Carbohydrate Metabolism
Carbohydrate metabolism에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 18개였다(Fig. 3B). 그 중에서 spot 62와 246번은 NADP-dependent malic enzyme으로 동정되었다. Malic enzyme은 세포질 내에서 말산을 탈탄산하여 이산화탄소와 피루브산으로의 전환을 촉매하는 효소이다(Wheeler et al., 2005). Spot 72번은 2,3-bisphosphoglycerate- independent phosphoglycerate mutase로 동정되었다. 이 효소는 해당과정인 D-glyceraldehyde 3-phosphate로부터 피루브산을 합성하는 경로에서 2-phosphoglycerate와 3-phosphoglycerate의 상호 전환을 촉매한다(Zhao and Assmann, 2011). Spot 97번은 UTP-glucose-1-phosphate uridylyltransferase로 동정되었다. 이 단백질은 포도당-1-인산을 다당류의 주요한 glycosyl donor인 UDP-포도당으로 전환하는 데 관여하는 효소로, 설탕, 녹말 및 세포벽의 합성, callose의 침착에 필수적으로 작용하는 것으로 알려져 있다(Meng et al., 2009). Spot 106과 114번은 enolase-like로 동정되었다. Enolase는 탄수화물을 분해하는 해당경로에서 2-phosphoglycerate를 phosphoenolpyruvate로 전환하는 과정을 촉매한다(Prabhakar et al., 2009). Spot 107번은 xylose isomerase-like로 동정되었는데, xylose isomerase는 D-xylose와 D-xylulose의 상호전환을 촉매화하는 이성질화효소이다(Nikolovski et al., 2012). Spot 273번은 ribulose-1,5-bisphosphate carboxylase/oxygenase large subunit(RuBisCO)으로 동정되었는데, 이 단백질은 이산화탄소 고정의 주요 과정인 D-ribulose 1,5-bisphosphate의 카르복실화 및 광호흡 과정에서 펜토스 기질의 산화적 단편화를 촉진한다(Izumi et al., 2012). Spot 333번은 phosphoglycerate kinase, cytosolic으로 동정되었다. 이 효소는 세포질에서 해당과정인 D-glyceraldehyde 3-phosphate로부터 피루브산을 생합성하는 과정에 포함되어 있으며, 3-phosphoglycerate로부터 3-phospho-glyceroyl phosphate를 생합성하는 과정을 촉매한다(Li et al., 2019).
Spot 335 및 350번은 2-methylene-furan-3-one reductase-like로 동정되었다. 딸기에서 methylene-furan-3-one reductase는 전자공여체로 NADH와 NADPH를 사용하여 주요 향기 화합물인 4-hydroxy-2,5-dimethyl-3(2H)-furanone의 생합성을 촉매하는 것으로 알려져 있다(Schiefner et al., 2013). Spot 337번은 fructose-bisphosphate aldolase cytoplasmic isozyme으로 동정되었다. Fructose-bisphosphate aldolase는 세포질과 엽록체에 분포하고 탄수화물 분해 과정인 포도당 신생과정에서 핵심적인 역할을 하며, β-D-fructose 1,6-bisphosphate를 D-glyceraldehyde 3-phosphate와 dihydroxyacetone phosphate로 분할하는 가역적인 과정을 촉매한다(Patron et al., 2004). Spot 344와 345번은 malate dehydrogenase로, spot 358번은 malate dehydrogenase, mitochondrial로 각각 동정되었다. Malate dehydrogenase는 (S)-malate 와 NADP+를 기질로 하여 피루브산, 이산화탄소 및 NADPH를 생산하는 효소로 세포질, 미토콘드리아 및 엽록체를 포함한 광범위한 세포의 각 소기관에 분포한다(Selinski et al., 2014). Spot 391번은 acidic endochitinase SE2-like, partial로 동정되었다. Acidic endochitinase는 곰팡이 병원체의 세포벽 성분인 키틴에 대한 방어 기능을 수행하는데, chitin과 chitodextrins에서 N-acetyl-beta-D- glucosaminide(1->4)-beta 결합의 무작위적인 endo-hydrolysis를 촉매한다(Yang et al., 2011). Spot 422번은 triosephosphate isomerase, cytosolic-like로 동정되었다. Triosephosphate isomerase, cytosolic은 세포질에서 탄수화물 생합성을 하는 포도당신생경로와 해당경로인 glycerone phosphate로부터 D-glyceraldehyde 3-phosphate를 생합성하는 경로에서 D-glyceraldehyde 3-phosphate와 dihydroxyacetone phosphate를 상호전환하는 과정을 촉매한다(Ito et al., 2003). Spot 461번은 L-gulonolactone oxidase-like로 동정되었다. L-gulonolactone oxidase는 L-ascorbate 생합성 경로에서 작용하며 L-gulono-1,4-lactone으로부터 ascorbic acid로의 산화를 촉매한다(Maruta et al., 2010). 한편 carbohydrate metabolism에 포함된 것들 중 10이상의 AV값을 갖는 것은 spot 114번(10.48)이었다.
Defense 및 Stress Response
Defense 및 stress response에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 9개였다(Fig. 3B). Spot 204번은 plasma membrane-associated cation-binding protein 1-like로 동정되었다. Plasma membrane-associated cation-binding protein 1은 PtdInsPs 및 calmodulin(CaM)과의 상호 작용을 통한 세포 내 신호전달에 관여하고 PtdInsPs 방출 및 InsPs-dependent signaling cascade의 후속적인 활성화를 야기한다(Kato et al., 2010). 또한 칼슘 의존적 방식으로 cortical microtubules을 불안정화하여 자엽 세포 신장의 음성조절자로서의 역할을 하며, 세포질 칼슘이 증가할 때 미세소관 탈중합을 증가시키기 위해 미세 소관에 직접 결합하고 불안정화시킨다. Spot 206번은 lactoylglutathione lyase로 동정되었는데, 이 단백질은 DNA, RNA 및 단백질과 같은 거대 분자와 반응하여 세포에 유해한 영향을 미치는 것으로 알려진 methylglyoxal (MG)(Thornalley et al., 1999) 및 glutathione으로부터 형성된 hemimercaptal의 S-lactoylglutathione으로의 전환을 촉매한다(Kwon et al., 2013). Spot 219번은 (+)-neomenthol dehydrogenase-like로 동정되었다. (+)-Neomenthol dehydrogenase는 5개 이상의 탄소를 갖는 포화 및 알파, 베타-불포화 알데히드에 대한 aldehyde carbonyl groups의 환원을 촉매하는 aldehyde 환원효소로서, 병원균에 대한 기본적인 저항성에 관여한다(Yamauchi et al., 2011). Spot 313번은 formate dehydrogenase, mitochondrial로 동정되었는데, 이 단백질은 미토콘드리아에서 formate로부터 이산화탄소로의 NAD+-dependent oxidation을 촉매하며 세포의 스트레스에 대한 반응에 관여한다(Hourton-Cabassa et al., 1998).
Spot 357번은 probable aldo-keto reductase 2로 동정되었다. Aldo-keto reductase는 광범위한 기질에 작용하는 oxidoreductase로 ketosteroids, aromatic aldehydes, ketones, sugars 및 기타 aliphatic aldehydes의 감소, hydroxysteroids의 산화, 포화 그리고 alpha, beta-불포화 aldehydes에 대한 aldehyde carbonyl groups의 환원을 촉매하며, 식물 스트레스 중에 생성되는 toxic aldehydes와 ketones을 감소시키는 무독화 효소로 작용할 수 있다(Yamauchi et al., 2011). Spot 447번은 agglutinin alpha chain-like로 동정되었다. Agglutinin은 D-galactose-specific lectin으로 T-antigen structure Gal-beta1,3-GalNAc에 결합한다. 독특한 T- 및 B- 세포 기능의 강력하고 선택적인 자극제로, 인간 혈청에서 IgA-1을 특이적으로 인식할 수 있다(Ngoc et al., 1993). Spot 465번은 glycine-rich RNA-binding protein GRP1A-like로 동정되었다. Glycine-rich RNA-binding protein은 스트레스 동안 RNA의 전사나 가공과정에서 역할을 하는데, 단일 가닥의 핵산을 선호하고 RNA 및 DNA 서열과 결합하며 poly(U) sequence에 대해 강한 친화력을 나타낸다. 저온 및 동결 조건과 같은 스트레스에 대한 적응 과정에서 RNA 샤페론 활성을 나타내며 내성을 발휘하는 것으로 알려져 있다(Kwak et al., 2005). Spot 479번은 glutathione S-transferase DHAR2-like, spot 480번은 glutathione S-transferase-like로 동정되었다. Glutathione S-transferase는 in vitro 조건에서 1-chloro-2,4- dinitrobenzene (CDNB)에 대한 glutathione S-transferase 활성과 cumene hydroperoxide 및 linoleic acid-13-hydroperoxide에 대한 glutathione peroxidase 활성을 보유하며, in vivo 조건에서는 다수의 외인성 및 내인성 hydrophobic electrophile들에 대한 환원형 glutathione의 결합에 관여하고 광범위한 해독작용과 스트레스 반응에도 관여한다(Lee and Bailey-Serres, 2019). 한편 defense 및 stress response에 포함된 것들 중 10 이상의 AV값을 갖는 것은 480번(10.48)이었다.
Protein Metabolism
Protein metabolism에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 7개였다(Fig. 3B). Spot 143번은 fumarylacetoacetase-like로 동정되었다. Fumarylacetoacetase는 tyrosine 이화경로의 마지막 단계에서 fumarylacetoacetate를 acetoacetate와 fumarate로 전환하는 과정을 촉매한다(Zhi et al., 2016). Spot 162번은 beta-cyanoalanine synthase 2, spot 163 및 164번은 beta-cyanoalanine synthase 1으로 각각 동정되었다. Beta-cyanoalanine synthase는 hydrogen cyanide와 L-cysteine으로부터 3-cyano-L-alanine을 합성하는 과정을 촉매하는데, 사과의 숙성과정에서 에틸렌 생합성으로부터 발생하는 시안 화합물의 무독화에 관여하는 것으로 알려져 있다(Han et al., 2007). Spot 165 및 166번은 glutamine synthetase cytosolic isozyme으로 동정되었다. Glutamine synthetase는 ATP, L-glutamate 및 NH4+으로부터 L-glutamine을 생합성하는 과정을 촉매한다(Tabuchi et al., 2005). Spot 449번은 eukaryotic translation initiation factor 5A-2-like로 동정되었다. Eukaryotic translation initiation factor는 mRNA의 특정 단백질 합성에 관여하고 다른 개시 인자와 함께 40S ribosome에 대한 mRNA 및 methionyl-tRNAi의 결합을 자극하는 진핵세포 번역 개시 인자 복합체의 성분이다(Yahalom et al., 2008). 한편 protein metabolism에 포함된 것들 중 10 이상의 AV값을 갖는 것은 163번(10.81) 및 166번(13.26)이었다.
Allergy
알레르기에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 6개였다(Fig. 3B). Spot 406번은 MLP-like protein 34, spot 455 및 456번은 MLP-like protein 329로 각각 동정되었다. Major latex protein(MLP)-like protein은 알레르기를 일으킬 수 있는 MLP의 유사체이다. 알레르기는 환경중에서 다수의 광범위한 원인들에 대한 면역계의 과민증에 의해 유발되는 질환으로, 이들 중 latex 알레르기는 천연 고무 latex를 함유한 제품에 반복적으로 노출된 후에 발생한다. Latex 알레르기가 있는 사람은 일부 식물 및 이들의 과일에 대하여 알레르기 반응을 보이거나 발병할 수 있는데, 이것을 latex-fruit syndrome이라고 한다(Brehler et al., 1997). 이 증후군과 관련된 과일 및 작물로는 사과, 바나나, 파인애플, 딸기, 감자, 토마토, 당근 및 콩 등과 같은 다양한 것들이 있으며, 이들 중 일부에는 latex protein 구조의 단백질들이 포함되어 있다. Spot 451 및 452번은 major allergen Mal d 1, spot 457번은 major allergen Mal d 1.06A01으로 각각 동정되었다. Major allergen Mal d 1은 네 가지 주요 사과 allergen들(Mal d 1, 2, 3 및 4) 중의 하나로 17.5kDa의 분자량을 갖는 자작나무 꽃가루의 주요 알레르기 항원 Bet v 1 및 pathogenesis-related protein(PRP)-10과 상동성을 갖는다(Herndl et al., 2007). Mal d 1은 PRP-10과 상동성을 띠고 있지만 다른 PRP-10과는 달리 사과 조직에서 구성 요소로서 발현되는 것으로 보이며, 성숙 외의 다른 발달 단계에서는 사과 고유의 생리학적 과정에 관여하는 것으로 보인다(Marzban et al., 2005). 한편 알레르기에 포함된 것들 중 10 이상의 AV값을 갖는 것은 451번(54.42) 및 455번(24.08)으로 다른 생리적 기능에 속하는 단백질들에 비해 발현 정도가 현저히 높은 것으로 나타났다.
ATP Synthesis
ATP synthesis에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 5개였다(Fig. 3B). Spot 100, 101 및 102번은 ATP synthase subunit beta, mitochondrial, spot 260번은 ATP1(ATPase subunit alpha, mitochondrial)으로 동정되었다. Mitochondrial membrane ATP synthase(F1F0 ATP synthase 또는 complex V)는 여러 개의 단백질 소단위체들이 모여서 이루어진 복합효소로 미토콘드리아에서 전자전달계에 의해 생성되는 막을 가로지르는 양성자 구동력에 의해서 ADP와 무기인산으로부터 ATP를 생성한다. 이 복합효소는 ATP 생산을 가능하게 하는 회전 기작을 갖는 2개의 주요 소단위체인 F1과 F0의 2개의 구조적 도메인으로 구성되는데, 소단위체인 알파 및 베타는 F1에서 촉매 기능을 수행한다(Junge and Nelson, 2015). Spot 438번은 ATP synthase subunit d, mitochondrial로 동정되었는데, 이 단백질은 ATP synthase F0 도메인의 구성 성분이다(Walker et al., 2005).
Antioxidant Enzyme
Antioxidant enzyme과 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 4개였다(Fig. 3B). Spot 274번(AR 2.18)은 glutathione reductase, cytosolic으로 동정되었다. Glutathione reductase는 세포내에서 산화 스트레스에 저항하고 세포의 환원 환경을 위해 중요한 역할을 담당하는 환원형 glutathione을 생성하는데, 1분자의 glutathione disulfide(GSSG)와 NADPH가 반응하여 2분자의 환원형 glutathione을 생성하는 과정을 촉매한다(Gill et al., 2013). Spot 298번은 monodehydroascorbate reductase로 동정되었는데, 이 효소는 반응경로에서 NADH를 산화시켜 monodehydroascorbate(MDA)를 ascorbate로 전환하는 과정을 촉매하며, 세포 내에서 산화적 손상을 일으키는 과산화수소의 해독에도 관여한다(Eastmond, 2007). Spot 421번은 L-ascorbate peroxidase, cytosolic-like로 동정되었는데, L-ascorbate peroxidase는 electron donor로써 L-ascorbate를 사용하여 과산화수소를 분해한다(Maruta et al., 2012). Spot 443번은 peroxiredoxin-2B-like로 동정되었는데, 2-Cys peroxiredoxin이나 peroxiredoxin은 과산화수소 및 organic hydroperoxide를 각각 물과 알코올로 환원시키는 촉매 작용을 하는 thiol-specific peroxidase로, 과산화물을 해독하여 산화 스트레스로부터 세포를 보호하는 역할을 한다. 특히 발달 중인 줄기나 광합성을 하는 잎에서는 항산화효소의 역할과 광계 II에서 과산화수소에 대한 보호작용을 한다(Lamkemeyer et al., 2006). 한편 항산화효소에 포함된 것들 중 10 이상의 AV값을 갖는 것은 421번(12.67)이었다.
Secondary Metabolite Metabolism
Secondary metabolite metabolism과 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 4개였다(Fig. 3B). Spot 148번은 acetyl-CoA acetyltransferase, cytosolic 1, spot 316번은 acetyl-CoA acetyltransferase, cytosolic 1-like로 동정되었다. Acetyl-CoA acetyltransferase는 2분자의 acetyl-CoA로부터 1분자의 acetoacetyl-CoA을 생성하는 과정을 촉매하는 효소로, 이 단백질은 acetyl-CoA로부터 대사중간체인 (R)-mevalonate를 합성하는 보조경로의 첫 단계에 포함된 효소이다(Jin et al., 2012). Spot 169번은 caffeic acid O-methyltransferase로 동정되었다. 이 단백질은 aromatic 화합물 대사경로에 속하는 phenylpropanoid 생합성 경로에 관여하는데 caffeic acid를 ferulic acid로, 5-hydroxyferulic acid를 sinapic acid로 변환하는 것을 촉매하며 생성된 변환물들은 lignin에 중합된 상응하는 알콜로 전환될 수 있다(Gowri et al., 1991). Spot 373번은 isoflavone reductase homolog로 동정되었다. Isoflavone reductase는 NADPH-dependent oxidoreductase의 일종으로, 담배의 경우 알칼로이드 생합성의 말기에 관여하는 환원 효소로 니코틴산 유래 전구체의 형성이나 알칼로이드의 최종 축합 반응과 관련이 있을 것으로 예상되며(Kajikawa et al., 2009), 알팔파에서는 주요 phytoalexin인 (‑)-medicarpin의 합성에 관여하는 것으로 알려져 있다(Paiva et al., 1991).
Protein Folding
Protein folding에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 3개였다(Fig. 3B). Spot 8번은 chaperonin 60 subunit alpha 1, chloroplastic으로 동정되었다. 새로 합성된 단백질은 보통 아미노산 사슬구조에서 3차원의 구조로 접혀야 하는데, chaperonin은 이와 같은 다른 단백질의 올바른 접힘에 유리한 조건을 제공하여 응집을 방지하는 작용을 한다(Hartl and Hayer-Hartl, 2009). Chaperonin 60 subunit alpha 1, chloroplastic은 RuBisCO 작은 소단위체와 큰 소단위체를 결합하고, RuBisCO 중합체의 조립 및 단백질과 연관된 접힘에 관여하며, 적절한 엽록체의 발달을 위해서도 필요하다(Suzuki et al., 2009). Spot 60번은 heat shock 70kDa protein(Hsp 70)과 유사한 heat shock cognate 70kDa protein 2로, spot 64는 Hsp 70, mitochondrial로 동정되었다. Hsp 70은 다른 chaperone들과 협력하여 de novo synthesized proteins의 접힘을 용이하게 하고, 전구체 단백질의 소기관 내로의 전좌를 지원하며, 스트레스 조건 하에서 손상된 단백질의 분해를 담당하는 주요 성분으로 알려져 있다(Latijnhouwers et al., 2010).
Protein Degradation
Protein degradation 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 3개였다(Fig. 3B). Spot 99와 105번은 leucine aminopeptidase 1-like로 동정이 되었다. Leucine aminopeptidase 1은 세포 내에 있는 단백질들의 가공 및 조절에 관여하는데, 다양한 펩티드로부터 치환되지 않은 N-말단의 아미노산들의 제거를 촉매한다(Bartling and Weiler, 1992). Cys-Gly dipeptidase activity을 보유하며, Cys-Leu 및 Leu-Cys dipeptide들도 절단할 수 있고, 단백질을 열에 의한 손상으로부터 보호하기 위한 분자 chaperone으로서도 기능한다(Scranton et al., 2012). Spot 115번은 mitochondrial-processing peptidase(MPP) subunit alpha로 동정되었다. MPP는 촉매 기능을 위해 협동적으로 작용하는 두 가지 구조적으로 관련된 소단위체인 알파 소단위체와 베타 소단위체를 포함하는 metalloendopeptidase이다(Teixeira and Glaser, 2013). MPP 알파 소단위체는 미토콘드리아 매트릭스에 위치하며 heterodimeric complex의 일부로서만 기능하지만, 미토콘드리아로 새롭게 유입된 전구체 단백질들의 선도펩티드로의 절단을 촉매한다(Nagase et al., 1996).
Nucleotide Metabolism
Nucleotide metabolism에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 2개였다(Fig. 3B). Spot 402번은 adenine phosphoribosyltransferase 1-like로 동정되었다. Adenine phosphoribosyltransferase 1(APT1)은 adenine으로부터 AMP를 합성하는 subpathway의 1단계에 관여하는데, 이 보조경로는 재생반응을 경유하는 AMP 생합성 경로의 일부이며 그 자체는 purine 대사의 일부이다. Adenine을 adenylate nucleotides로 재순환시키는 데 주로 기여하지만 phosphoribosylation에 의해 활성형의 cytokinin을 불활성형으로 전환한다(Sukrong et al., 2012). APT1의 활성이 감소하고 세포의 adenine 수준이 증가한 식물은 스트레스 내성이 강화되고 성장이 개선되어 식물 바이오 매스가 증가하는 것으로 알려져 있다(Sukrong et al., 2012). Spot 500번은 nucleoside diphosphate kinase 1로 동정되었다. 이 단백질은 ATP 이외의 nucleoside triphosphate들의 합성에서 주요 역할을 하는데, ATP gamma phosphate는 인산화된 활성 부위 중간체를 사용하여 NDP beta phosphate로 옮겨진다(Kopylov et al., 2015). 또한, 과도한 활성산소에 대하여 내성을 증가시키는 역할도 수행한다(Fukamatsu et al., 2003).
Cell Division
Cell division에 관련된 것으로 동정된 단백질 spot들 중 AV가 2.0 이상인 것은 405번이며 translationally-controlled tumor protein homolog로 동정되었다(Fig. 3B). Translationally-controlled tumor protein은 식물의 전반적인 발달을 위해 필요한 일반적인 조절자로서 세포주기의 지속 기간을 조절하는 것으로 알려져 있다(Hoepflinger et al., 2013).
Cytoskeleton
Cytoskeleton에 관련된 것으로 동정된 단백질들 중 AV가 2.0 이상인 spot은 150번이며, actin(Fragment)로 동정되었다(Fig. 3B). Actin은 미세섬유를 형성하는 globular multi-functional protein으로 본질적으로 모든 진핵 세포에서 발견된다. Actin은 세포이동, 근육의 긴장 조절, 세포 분열, 세포 소기관의 이동, 세포의 형태 확립 및 유지를 비롯한 많은 중요한 세포적인 과정에 참여하는데, 이러한 과정들 중 다수는 actin과 세포막의 광범위하고 긴밀한 상호 작용에 의해 매개된다(Doherty and McMahon, 2008).
이상과 같이 국내 육성 사과 품종인 ‘홍로’ 과피에서 발현되는 단백질체를 분석한 결과 pI 4 ‑ 8 영역에서 대부분의 단백질이 발현되었으며, 그 중 502개의 단백질들이 반복적이고 일관되게 발현되는 것으로 확인되었다. 이들 단백질들을 MALDI- TOF/TOF로 분석한 결과, 408개의 단백질들이 동정되었으며 그 생물학적 기능이 파악되었다. 동정된 단백질들을 생물학적 기능별로 정리한 결과, carbohydrate metabolism에 속하는 것들이 87개로 가장 많았으며, 그 다음은 protein metabolism 59개, protein folding 37개, defense 및 stress response 35개, protein folding 33개, antioxidant enzyme 29개, secondary metabolite metabolism 16개, lipid metabolism 16개, transport 15개, cytoskeleton constitution 14개, allergy 12개, nucleotide metabolism 11개, ATP synthesis 10개 등의 순이었다. 또한 사과의 과피에서 동정된 것들 중 알레르기와 관련된 단백질들이 대량으로 발현되는 것이 확인되었다. 이상의 결과는 추후 사과의 재배 및 육종 분야에서 과일의 성숙과 영양적 가치 향상을 위한 유용 단백질의 증가 및 알레르기와 관련 단백질 등의 감소를 포함한 다양한 연구를 위해 이용될 수 있을 것이다.
Supplementary Material
Supplementary materials are available at Horticultural Science and Technology website (https://www.hst-j.org).
- HORT_20200072_Table_1s.pdf
Identification of expressed proteins in the peel of the Malus domestica ‘Hong-ro’
- HORT_20200072_Table_2s.pdf
Functional classification of expressed proteins in the peel of Malus domestica ‘Hong-ro’




