서 언
재료 및 방법
오염균의 분리 및 동정
공시 약제의 오염균 생장 억제 효과
선발 약제 혼합 첨가 배지에 대한 감자 조직배양묘의 반응조사
결과 및 고찰
식물병원성 세균의 동정 및 항생제의 처리 효과
식물병원성 균류의 동정 및 살균제의 처리 효과
살균제와 항생제의 혼용처리가 식물의 생육에 미치는 영향
서 언
감자는 기후 적응성이 뛰어나고 비교적 적은 양의 관개용수와 비료의 사용만으로도 높은 수확량을 기대할 수 있다(Hussain, 2016). 또한, 우수한 식미와 식물성 섬유를 다량으로 함유하고 있어 식용과 가공품 생산을 목적으로 국내·외적으로 널리 재배되고 있다(Zaheer and Akhtar, 2014; KOSIS, 2018; Furrer et al., 2018). 감자는 괴경을 이용하여 번식되는 작물로서 오래전부터 씨감자 생산체계에 의해서 농가에 공급되어 왔다. 하지만, 일반적인 영양 번식방식에 의해서 생산되는 씨감자는 높은 병리적, 생리적 퇴화율로 인해서 증식 효율이 떨어질 뿐만 아니라 종서의 품질도 균일하지 않기 때문에, 농가에서의 안정적인 수량성과 품질의 확보를 어렵게 할 수 있다(Cho et al., 2010). 따라서 감자 산업 분야에서는 조직배양 기술을 이용하여 품질이 균일한 무병 씨감자를 생산하고 공급하는 것이 매우 중요하게 여겨지고 있다(Mohapatra and Batra, 2017).
조직배양을 위한 배지는 식물 조직뿐만 아니라 식물체 및 배양 과정 중에 잔류하고 있던 미생물의 생장에도 좋은 영양 공급원으로 작용하게 된다. 이때 잔류하고 있던 미생물은 식물체 배양을 위한 조직과 영양분을 두고 경쟁을 함으로써 식물 조직의 발육을 저해하는 요인으로 작용하게 된다(Hussain et al., 2012; Medjemem et al., 2016). 또한, 이는 옥살산염과 아플라톡신 같은 독성물질을 생산함으로써 식물체의 사멸을 유도하는 원인으로서 작용할 수도 있다(Obuekwe and Osagie, 1989). 실제 미생물에 따른 오염은 많은 식물체에서 배양 개시 또는 계대배양 과정 중에 빈번하게 발생하고 있는 문제이다(Leifert et al., 1989; Orlikowska et al., 2017).
이는 생장점배양으로 무병 개체를 확보하고, 이들의 계대배양을 통해서 대량으로 식물체를 증식한 후 묘를 순화하여 소괴경을 생산하게 되는 씨감자 생산 체계에도 경제적 손실을 초래하는 중요한 원인이 되고 있다. 씨감자 생산 효율을 결정하는 중요한 과정인 계대배양 중의 오염은 실험실이나 식물체에 잔류하고 있던 유해 미생물에 의해서 주로 발생하기 때문에 배양 개시 과정에서 발생되는 오염원들에 비해 미비한 수준으로 식물체에 영향을 미치는 경우가 많다(Reed and Tanprasert, 1998). 따라서 씨감자 생산체계에서는 배지 오염원을 제거할 목적으로 식물체 생장에 영향을 미치지 않는 농도의 살균제와 항생제를 조기에 처리할 수 있다면 경제적 손실을 회피할 가능성이 크다.
하지만, 조직배양 과정 중 발생하는 오염원의 종류는 식물체에 따라서 다를 뿐만 아니라 식물체의 생장 및 오염원의 제거에 미치는 살균제와 항생제의 영향도 그들이 가진 화학적 성분이나 적용 농도 간의 상호작용에 따라서 달리 나타날 수 있다(Mng’omba et al., 2012; Ray et al., 2017). 조직배양 과정 중에 살균제와 항생제를 적용하기 위해서는 관심 작물에서 발생할 수 있는 오염원을 매우 정확하게 동정하고, 이들을 효율적으로 제거하면서도 식물체의 생육을 저해하지 않는 살균제와 항생제를 선발하고 농도를 결정하는 과정이 선행될 필요성이 있다. 비록 배지의 오염은 씨감자 생산체계에 있어 큰 문제이지만, 현재까지 감자에서는 이러한 오염을 초래하는 오염원에 대한 동정과 이들의 제어를 위한 연구는 전무한 실정이다.
따라서 본 연구는 국내에서 가공을 목적으로 가장 많이 재배되고 있는 (i) ‘대서(Atlantic)’ 감자의 계대배양 과정 중 발생하게 되는 오염원을 염기서열을 기반으로 정확하게 분리·동정하고, (ii) 오염원의 억제를 위한 항생제와 살균제의 효능을 평가하고, (iii) 선발된 살균제와 항생제의 처리에 따른 식물체의 생육을 조사함으로써 배지 오염에 따른 경제적 손실을 예방할 수 있는 약제를 선발하기 위한 기초자료를 확보하기 위하여 수행되었다.
재료 및 방법
오염균의 분리 및 동정
‘대서(Atlantic)’ 감자의 조직배양 과정에서 발생 가능한 오염균을 동정하기 위해서 2016년 10월부터 2017년 2월까지 강릉원주대학교 식물생명과학과 식물조직배양실에서 발생된 오염 배지에서 세균과 균류를 분리하였다. 분리된 세균과 균류는 추가적인 실험을 위해서 각각 NA(nutrient agar, Difco Laboratories, USA)와 PDA(potato dextrose agar, Difco, USA) 배지에 접종한 다음 25°C에서 3일간 배양함으로써 순수 배양체를 확보하였다. 이후 분리한 오염균들은 신선한 PDA 또는 NA 배지에서 배양한 후, 4°C에서 보관하며 실험에 사용하였다. 순수하게 분리된 세균과 균류의 동정은 DNA Extraction Kit(DNeasy Plant Mini, Qiagen, Germany)의 프로토콜에 따라 추출된 Genomic DNA를 이용하여 16S rRNA 유전자와 ITS(Internal Transcribed Spacer)의 염기서열 분석을 통해서 수행하였다. 16S rRNA 영역의 염기서열은 27F(5’-AGA GTT TGA TCM TGG CTC AG-3’)과 1492R(5’-TAC GGY TAC CTT GTT ACG ACT T-3’) primer를 사용하여 증폭된 PCR 산물(Lane et al., 1985)을, ITS 영역의 염기서열은 ITS1(5’-TCC GTA GGT GAA CCT GCG G-3’)과 ITS4 primer(5’-TCC TCC GCT TAT TGA TAT GC-3’)를 이용하여 증폭된 PCR 산물(Gardes and Bruns, 1993)을 Solgent사(Daejeon, Korea)에 분석을 의뢰함으로써 확보하였다. 분석된 염기서열은 NCBI에서 BLAST search를 통해 일치도가 가장 높은 종을 확인하기 위해 활용되었다.
공시 약제의 오염균 생장 억제 효과
‘대서’ 감자의 조직배양 과정에서 발생하는 오염균의 제어 가능성을 검토하기 위한 실험은 약제의 작용기작과 조직배양에서의 적용 가능 여부를 기초로 3종의 항생제와 4종의 살균제를 선정하여 수행하였다(Table 1). 공시된 항생제가 오염 세균의 생장 억제에 미치는 영향은 paper disc를 이용한 활성 측정법을 이용하여 검정하였다. Paper disc 법의 적용을 위해서 배양한 세균의 colony를 NA 평판 배지에 도말한 후 paper disc(Ø8×H1.5mm, Kenis, Japan)를 접종된 배지 위에 놓고 25, 50, 100, 200µg·mL-1 농도의 항생제를 30µL씩 처리하였다. 이후 세균을 접종한 배지는 거꾸로 뒤집은 채로 25°C에서 4일간 배양되었으며, 배양 최종일에 버니어캘리퍼스로 clear zone의 지름을 측정하였다. 본 실험을 위한 대조구로는 paper disc에 100µg·mL-1 농도의 acetone 30µL를 접종한 처리구가 사용되었으며, 본 실험은 3회에 걸쳐서 수행되었다.
Table 1. The list of antibiotics and fungicides used in this study
공시된 살균제가 본 실험에서 동정된 균류의 생장 억제에 미치는 영향은 균사 생장의 억제 정도를 조사하여 검정하였다. 이를 위해 각 균류의 균사 조직을 PDA 배지에 접종하여 25°C에서 4일간 배양하였으며, 균총의 선단에서 발생한 직경 3mm의 조각을 떼어내어 접종원으로 사용하였다. 이후 공시된 살균제를 멸균된 증류수에 용해 시켜 실험용 배지의 최종 농도가 25, 50, 100, 200µg·mL-1이 되도록 첨가하였다. 정해진 농도로 살균제를 첨가한 PDA 배지에 병원균의 균사는 25°C에서 2일간, 균핵은 동일한 배양 조건에서 3일간 배양한 후 균총의 직경을 조사하였다. 살균제 처리에 따른 균사 생장 억제율은 살균제를 첨가하지 않은 PDA 배지 상에서의 측정된 병원균 균총의 직경과 살균제가 첨가된 PDA 배지에서 측정된 균총의 직경을 아래와 같은 식에 대입하여 산출하였다.
균사 생장 억제율(%) = (1-살균제 첨가 PDA의 균총 지름/무처리 배지의 균총 지름) × 100
모든 실험은 적정 처리농도를 구명하고자 균사생장을 50% 억제하는 살균제의 농도(EC50; effective concentration inhibiting mycelial growth by 50%)를 구하여 비교하였다.
선발 약제 혼합 첨가 배지에 대한 감자 조직배양묘의 반응조사
선발된 살균제와 항생제의 배지 첨가가 감자 조직 배양묘의 생육에 미치는 영향은 강릉원주대학교 식물생명과학과의 조직배양실에서 수행되었다. 본 실험을 위하여 기내 배양되었던 ‘대서’ 식물체 중에서 균일한 크기를 가진 줄기 절편체를 15개씩 채취한 후 살균제와 항생제를 첨가한 MS 기본 배지에 치상하여 60일간 배양하였다. 이후 식물체의 생육 정도는 아무런 약제가 처리되지 않은 배지에서 자란 식물체와 살균제와 항생제가 처리되었던 배지에서 생육하였던 식물체 간의 차이를 비교하는 방식으로 평가하였다. 이를 위해서 실험에 이용된 배지에서 식물체를 분리한 후 지상부와 지하부의 무게를 전자저울(ER-120A, AND, Japan)로 측정하였으며, 지상부와 지하부의 길이를 버니어 캘리퍼스(530-190, Mitutoyo, Japan)를 활용하여 측정하였다. 본 실험을 위해서 배지 조제 과정에서 첨가된 살균제는 균사 생장 억제율과 EC50 값이 우수하였던 fluazinam과 pyraclostrobin이었으며, 항생제는 세균에 대한 생장 억제 효과가 있었던 penicillin G와 vancomycin이었다.
결과 및 고찰
식물병원성 세균의 동정 및 항생제의 처리 효과
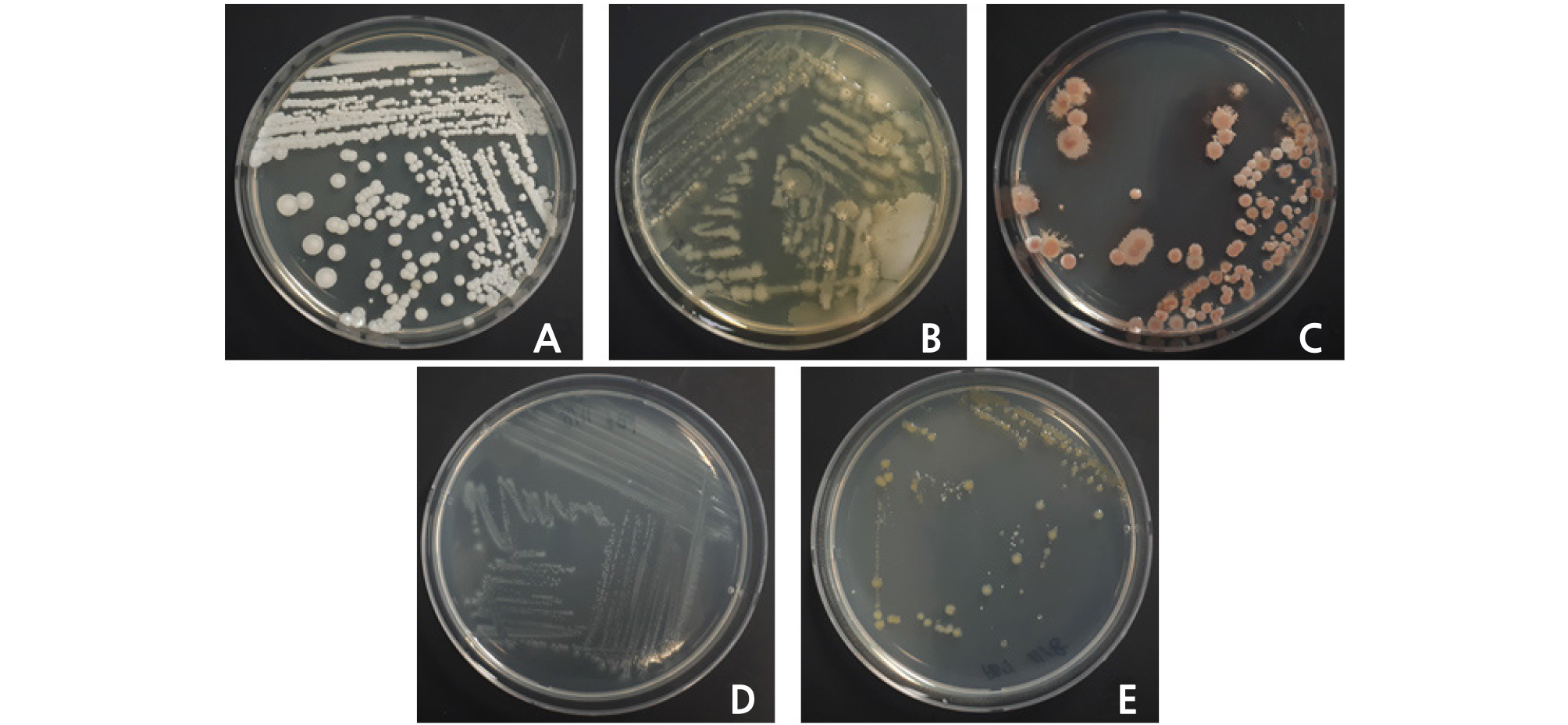
본 실험과정 동안 분리된 세균과 균류는 각각 potato bacteria의 약어인 PB와 potato fungus의 약어인 PF라는 명칭을 부여하여 구분하였다. 육안을 통해서 실험과정 동안 발생한 PB는 7종으로 추정되었으나, 16S rRNA 분석 유전자로 세균의 유전자 염기서열의 상동성을 분석한 결과를 통해서 Achromobacter sp.(PB1), Stenotrophomonas sp.(PB2 & PB3), Ochrobacterum sp.(PB4 & 5), Methylobacterium sp.(PB6), Staphylococcus sp.(PB7) 같은 5종의 내생형 세균이 발생한 것을 확인할 수 있었다(Table 2 and Fig. 1).
Table 2. Identification of bacteria isolated from the process of tissue culture in the 'Atlantic' potato
조직배양 중에 발생하는 미생물에 의한 오염은 감염된 식물체의 사용과 부적절한 조직배양 환경에 의해서 주로 발생하게 된다. 조직배양은 토양과 공기에 노출된 환경에서 생육을 유도한 식물체를 대상으로 하게 된다. 식물은 기본적으로 토양과 재배 환경상에 존재하는 다양한 미생물과의 공생 관계를 통해서 유지되기 때문에 조직배양 시 발생하게 되는 미생물의 오염경로를 정확하게 파악하는 것은 어렵다. 하지만, 분명한 사실은 세균 중 착생형은 식물의 표면에 존재하고 있어 화학약제의 적용으로 제거할 수 있어 조직배양 중에 문제를 일으키는 빈도가 낮다는 것이다(Hirano and Upper, 1990). 이에 반해, 식물체 내부 조직에 존재하는 내생형 세균은 단순한 표면소독 방법으로 제거되지 않아 조직배양 과정 중 오염을 일으키는 주요 원인으로 작용하고 있다(Leifert and Cassells, 2001).
이들은 배양 개시 과정 중 바로 문제를 일으키기도 하지만, 식물체에 존재하고 있다가 계대배양 중 상처나 자연 개구 등에 의해서 활성화되고 조직배양에 이용되는 배지의 양분을 이용하여 군체를 형성함으로써 식물체에 해로운 영향을 미치는 경우가 많다(Odutayo et al., 2007). 조직배양 동안 내생형 세균에 따른 경제적 피해를 회피하기 위해서는 오염 개체를 제거하는 것이 매우 중요하다. 비록 세균에 의한 피해는 계대배양 후 빠르면 1주일, 느리면 수개월 이후에 발생되기 때문에(Leifert et al., 1991), 세균에 오염된 개체의 제거를 위한 시간적 여유는 충분한 편이다. 하지만, 세균들의 경우 배지에서 문제를 일으키기 전까지는 외형적으로 발생 여부를 인지하기 어려운 문제점이 있어 본 실험과정에서 나타나는 내생형 세균들의 경우 오염원의 제거가 아닌 항생제의 처리를 통해서 세균의 사멸을 유도하는 방법을 활용하기도 한다.
항생제는 크게 세균을 직접 사멸시키는 살균성과 세균의 생성을 예방하는 제균성으로 나뉘고 있지만, 내생 세균을 제거하기 위해서는 살균성 항생제를 사용하는 것이 더욱 큰 이점이 있다는 보고가 있다(Fisse et al., 1987; Leifert et al., 1992). 따라서 본 실험에서도 세균의 세포벽 합성을 저해하는 능력이 있는 몇 가지의 살균성 항생제를 이용하여 세균의 제어 가능성에 대해서 검정하고자 하였다. 본 실험을 위해서 공시된 ampicillin은 그 어떠한 세균에 대해서도 clear zone을 형성하지 못하였으며, 조직배양 과정 중 많은 식물체에서 효과를 보여 왔던 penicillin G와 vancomycin도 Stenotrophomonas sp.와 Staphylococcus sp.에 대해서만 clear zone을 형성하여 공시된 항생제들의 경우 ‘대서’ 감자에서 발생할 수 있는 일부의 세균만을 제어할 수 있음을 확인하였다(Table 3). 이는 공시된 항생제들이 ‘대서’ 감자에서 발생되는 세균의 세포벽을 관통할 수 있는 충분한 능력이 없었기 때문으로, ‘대서’ 감자에서 조직배양 시 세균에 의한 배지의 오염을 완벽하게 회피하기 위해서는 차후 보다 다양한 종류의 항생제를 이용한 검정이 필요한 것으로 생각되었다. 하지만, 본 실험에서 나타난 clear zone의 지름을 참고할 경우 식물에 대한 부작용을 최소화할 수 있는 저농도의 적용만으로도 세균을 효율적으로 억제할 가능성이 있는 것을 확인할 수 있었다. 이외에도, 본 실험결과 Reed et al.(1998)의 보고에서처럼 ‘대서’ 감자에서도 항생제의 단용 처리만으로는 다양한 세균을 제어하기 어려울 것으로 판단되었다. 실제 대부분 항생제는 세균에 대한 좁은 표적 범위를 가지고 있어 몇 가지 항생제를 순서대로 또는 단계별로 사용하여 항생제 간의 상승효과를 유도함으로써 오염원을 제거하는 방식이 일반화되어 있기 때문에(Reed et al., 1995; Altan et al., 2010), 추가 실험과정에서는 저농도를 중심으로 다양한 항생제의 혼용처리 효과에 관한 연구도 필요할 것으로 생각된다.
Table 3. Effect of antibiotics on growth inhibition of bacteria isolated from this study
식물병원성 균류의 동정 및 살균제의 처리 효과
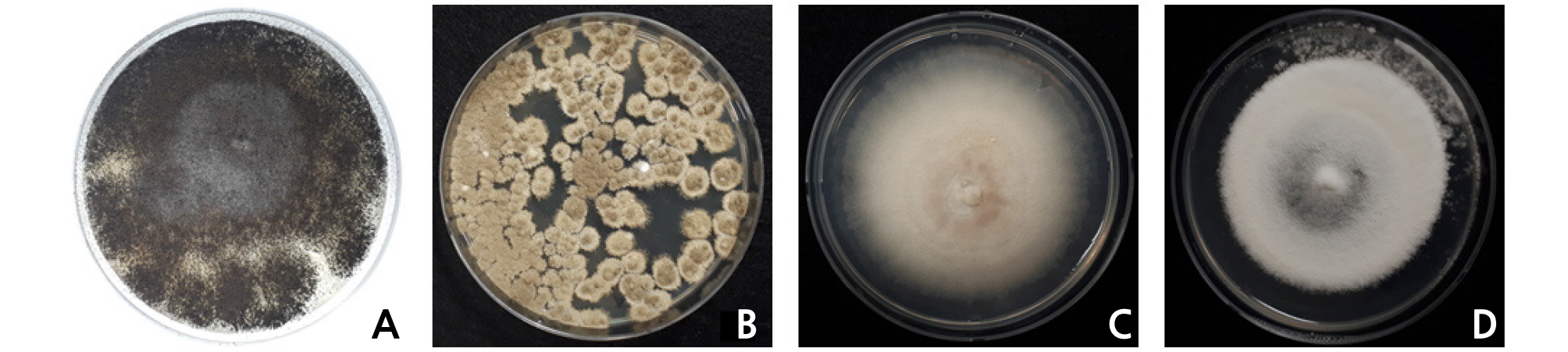
본 실험과정 중 육안을 통해서 실험과정 동안 발생한 PF는 6종으로 추정되었으나, 염기서열을 기반으로 종을 분류한 결과 Aspergillus niger(PF1 & PF6), Cladosporium sphaerospermum(PF2), Simplicillium lamellicola(PF3 & PF5)와 Purpureocillium lilacinum (PF4)와 같은 4종의 PB가 발생한 것을 확인할 수 있었다(Table 4 and Fig. 2). 본 연구에서 분리된 균류 중 A. niger는 토양이나 물, 그리고 식물 표면에서 쉽게 찾아지는 외생 균류로, 조직배양 과정 중 발생하는 오염원으로서 빈번하게 보고되고 있다(Abass, 2013; Helaly et al., 2014). A. niger는 수산염을 생산함으로써 식물체 조직을 사멸시킬 수 있는 위험성을 가지고 있는 것으로 널리 알려져 있다(Obuekwe and Osagie, 1989). 이와 함께 동정된 C. sphaerospermum은 대표적인 공기 전염성 균주로서(Hocking et al., 1994), 식물체에 내생 하지만 감자가 아닌 감귤류에 주로 부정적인 영향을 끼치고 있어 본 실험에서는 외부적인 요인에 의해서 도입되었을 가능성이 큰 것으로 생각되었다.
Table 4. Identification of fungi isolated from the tissue culture process in the 'Atlantic' potato
이러한 외생 균류들은 착생형 세균들과 마찬가지로 표면 소독기술의 적용만으로도 쉽게 제거될 수 있다. 따라서 본 실험에서 발생한 A. niger와 C. sphaerospermum는 조직배양 도구의 불충분한 소독, 실험실 내 불충분한 환기에 따른 오염 또는 계대배양 과정 중 실험자의 부주의로 인해서 발생한 것으로 추정되었다. 이와 달리 S. lamellicola와 P. lilacinum는 조직 배양 과정 중에는 빈번하게 보고되지 않은 내생 균류로서 본 실험환경에 특이적으로 또는 감자에서만 발생 가능한 오염원으로 판단되었다. 가령 S. lamellicola는 감자에서도 많은 문제가 되는 잿빛곰팡이에 중복기생하는 균주로(Choi et al., 2008), 이는 기주식물인 감자 조직배양 묘에 다른 병원성 균류와 함께 중복기생하였던 것으로 추정되었다.
식물에 존재하는 내생균 중 일부는 이차 대사산물의 생산을 통해서 잡초와 병원균 그리고 각종 환경 스트레스로부터 식물을 보호하는 역할을 하는 것으로 알려져 있다(Bastias et al., 2017; Contreras-Cornejo et al., 2018). 하지만, 완전한 무균 상태가 유지되어야 하는 식물 조직배양에서는 어떠한 유용균이라도 배지 오염의 문제가 될 수 있다. 일반적으로 내생형 균류는 외생형 균류와는 다르게 표면소독만으로 제거하기 힘들어, 이를 완벽하게 제어하기 위해서는 염화수은과 같은 강력한 소독액 또는 침투성 살균제의 적용이 불가피한 것으로 보고되어 있다(Danso et al., 2011). 본 실험을 위해서 공시된 살균제의 처리 효과를 평가한 결과, 실험에 사용된 살균제 모두 동정된 4종의 균류에 대해서 균사 억제 효과가 있었지만 chlorothalonil와 mancozeb의 경우 이들을 제어하는 효과가 탁월한 수준은 아닌 것으로 조사되었다(Table 5). 반면, 탈공역제로 작용하여 균류의 ATP 생산을 저해함으로써 살균작용을 하게 되는 보호 살균제 계열의 fluazinam(Liang et al., 2015)과 미토콘드리아 호흡에 관여하는 cytochrome bc1 효소복합체 활성을 억제하는 것으로 알려진 strobilurin 계열의 pyraclostrobin(Fisher et al., 2004)는 배양 시 나타나는 균류를 매우 효율적으로 제어할 수 있는 것으로 확인되었다.
Table 5. Antifungal activities of fungicides on mycelial growth of contaminant fungi during subculturing in the 'Atlantic' potato
A. niger 균주의 경우 fluazinam을 처리 시 EC50 값을 기준으로 35.5ppm 수준에서 균사의 생장을 가장 효율적으로 억제할 수 있었고, 나머지 3종의 균류들은 pyraclostrobin 처리 시 7.4 - 134.4ppm 범위의 EC50 값으로 균사의 생장이 억제되는 것으로 조사되었다. 특이한 점은 fluazinam의 경우 A. niger뿐만 아니라 다른 3종의 균류의 생장에 대해서도 우수한 억제 능력을 보였던 반면, fluazinam와 동일한 그룹에 속한 chlorothalonil의 경우 일부 균류에 대해서는 생장 억제 능력이 급격하게 떨어지는 양상을 보였다는 것이다. 이는 보호 살균제 그룹에 속하는 살균제들의 경우 특정한 균류의 생장에 미치는 영향이 다른 그룹에 속하는 살균제들에 비해서 차이가 클 수 있었다는 다른 연구자의 결과와 매우 유사한 것이었다(Lee et al., 2017). 따라서 조직배양 과정에서도 보호 살균제를 사용하고자 하는 경우 동일 그룹에 속하는 다양한 종류의 살균제의 공시를 통해서 억제 효과를 검정할 필요성이 있는 것으로 생각되었다. 이러한 사실과는 상관없이 fluazinam 또는 pyraclostrobin은 ‘대서’ 감자의 조직배양 동안 균류에 의한 오염을 회피하려는 방법으로 추가적인 살균제 선발 과정이 없이도 활용될 수 있을 것으로 판단된다.
살균제와 항생제의 혼용처리가 식물의 생육에 미치는 영향
상기의 실험을 통해서 특정한 살균제와 항생제의 처리가 ‘대서’ 감자의 계대배양 시 발생 가능한 오염원을 억제하는 효과가 있음을 확인할 수 있었다. 기내 식물체는 기외 식물체보다 화학물질의 적용에 따른 독성작용에 더욱 취약한 특성이 있기 때문에, 본 연구에서는 선발된 항생제와 살균제의 혼합이 식물체 생장에 미치는 영향에 대해서도 세균과 균류를 제어하기 위해서 가장 효율적일 수 있는 농도를 적용하여 추가적인 검정을 수행하였다(Table 6, Fig. 3). 본 실험을 위해서 선정된 항생제와 살균제 조합들을 이용하여 조직배양을 수행한 결과 아무것도 처리되지 않은 배지에서 관찰된 세균과 균류에 의한 배지 오염이 발생하지 않은 것으로 나타났다. 하지만, 주요 생육 지표 중 줄기의 길이 생장을 제외하고는 모든 항생제와 살균제의 혼용처리 구간이 식물체의 생육을 억제하는 것을 관찰할 수 있었다. 특히 vancomycin 25ppm과 fluazinam 200ppm 혼용 처리구의 경우 지상부와 뿌리의 길이가 각각 17.3cm와 13.4cm로서 무리구에 비해서 35%와 41% 정도를 억제하였다. 또한, penicillin G 25ppm과 pyraclostrobin 200ppm의 혼용처리 시 이와 유사한 비율로 줄기와 뿌리의 신장 등이 억제되는 것으로 조사되었다. 이는 화학약제의 처리 시 조직배양 중에 나타날 수 있는 갈변과 식물 형태의 변화와 함께 보고되고 있는 대표적인 독성작용의 발생 결과로 판단되었다(Niedz, 1998; Irshad et al., 2017). 반면, penicillin G 25ppm과 fluazinam 200ppm 또는 vancomycin 25ppm과 pyraclostrobin 200ppm을 혼합하여 배지에 처리한 경우에는 식물체의 외형적 특성을 포함한 생육 상이 무처리구와 비교 시 큰 폭의 차이를 나타내지 않아 독성반응을 보이지 않는 것으로 판단되었다. 이는 penicillin G 25ppm과 fluazinam 200ppm 또는 vancomycin 25ppm과 pyraclostrobin 200ppm을 첨가한 배지에서는 식물체의 생장을 저해하지 않으면서 세균과 균류로부터 배지 오염을 억제할 수 있음을 나타내는 결과로 생각되었다. 다만 본 연구 결과에서 주의 깊게 볼 점은 항생제와 살균제 적용에 있어 약간의 조합 변화만으로도 물리 또는 화학성의 변화로 인해서 독성작용이 나타날 가능성이 크다는 점에 있었다. 따라서 차후에는 화학약제의 조합과 농도 및 독성작용에 대한 연관성에 관한 연구도 필요할 것으로 생각되었다.
Table 6. Effects of the combined application of antibiotic and fungicide on the growth of 'Atlantic' potato plants cultured in vitro
식물조직배양 과정 중의 오염은 작업자 또는 배양기구의 부적절한 소독, 그리고 식물체에 숨어 있거나 계대배양 과정 중 도입된 미생물이 있을 때 발생할 수 있으며, 이들 중 균류와 세균에 의한 오염은 상당한 수준의 경제적 손실을 일으켜 왔다(Fang and Hsu, 2012; Quambusch et. al, 2016). 본 실험을 통해서 ‘대서’ 감자에서도 조직배양 중 다양한 경로를 통해서 미생물 오염원의 발생 가능성이 큰 것을 확인할 수 있었다. 특히 일부의 오염원은 외부적인 요인에 따라서 발생하는 것으로서 작업자의 철저한 살균작업만으로 제어할 수 있는 것이었지만, 대부분의 다른 오염원들은 일반적인 살균법으로 제어하기 힘든 종류의 것임을 확인할 수 있었다. 일반 재배과정에서는 이러한 강력한 오염원을 제어하기 위해서 살균제와 항생제를 사용하는 것이 일반화되어 있다(Ngegba et al., 2018; Sarkar et al., 2018). 하지만, 광합성 기구의 발달이 온전치 않고 외부의 스트레스에 대해서도 취약한 조직배양묘에 살균제와 항생제를 처리하는 것은 미생물 오염원뿐만 아니라 식물의 미토콘드리아와 엽록소의 형성도 쉽게 억제하기 때문에 사용이 매우 제한되어 왔다(Pollock et al., 1984; Kulkarni et al., 2007; Teixeira da Silva et al., 2017). 이러한 독성작용이 문제 시 되는 작물에서는 열과 광 처리 기술의 적용이 대체기술로서 제한되기도 하였지만(Sen et al., 2013), 처리 강도와 시간의 설정이 쉽지 않은 문제점으로 인해 뚜렷한 해답을 제시하지 못해왔다. 하지만, 본 실험결과 ‘대서’ 감자의 조직배양 과정 중에는 일부의 항생제와 살균제를 사용했을 경우 독성작용을 일으키지 않으면서도 오염원의 발생을 억제할 수 있는 것으로 나타났다. 따라서 ‘대서’ 감자의 조직배양 과정 중에는 몇 가지 사항에 대한 보완이 이루어지게 된다면 화학약제의 처리 기술이 산업적인 측면에서 매우 효율적으로 이용될 수 있을 것으로 판단된다.