서 언
재료 및 방법
시험 재료
HPLC-UVD/MS 기기분석 조건
표준검량선 및 분석정량한계(Limit of quantitation, LOQ)
시료 추출 및 분배
Florisil 흡착 크로마토그래피
Fenamidone의 회수율 검정
결과 및 고찰
HPLC 분석조건의 확립
시료 추출 및 분배
Florisil 흡착 크로마토그래피
Fenamidone의 분석정량한계 및 회수율
LC/MS를 이용한 잔류분의 재확인
서 언
Imidazolinone계 살균제 fenamidone[(S)-1-anilino-4-methyl-2-methylthio-4-phenylimidazolin-5-one, Fig. 1]은 엽면살포를 통하여 균류로부터 작물체를 보호 및 치료할 목적으로 사용되며, 작용기작은 미토콘드리아의 호흡을 억제함으로써 균류에 대한 방제효과를 나타낸다. Fenamidone은 주로 각종 채소 및 과일류를 대상으로 흑반병을 일으키는 Alternaria 속, 역병을 일으키는 Phytophthora 속 및 노균병을 일으키는 Peronospora 속의 균류 방제에 효과가 있으며, 바나나에서의 Mycosphaerella 균을 방제하는 데에도 사용된다고 보고되고 있다(Paranhape et al., 2014). 그리고 fenamidone은 저독성 농약으로 인도, 미국, 영국, 캐나다, 덴마크, 핀란드, 독일, 그리스 및 남아프리카공화국 등 다양한 국가에 사용이 등록되어 있다(Paranhape et al., 2014). 국내에서는 주로 고추의 역병 및 오이의 노균병에 사용되며(KCPA, 2015), 이에 대한 국내 농약잔류허용기준(maximum residue limits: MRL)은 0.1 - 5.0mg·kg-1 범위로 설정되어 있다(Ministry of Food and Drug Safety, 2014).
Fenamidone의 물리화학적 특성을 살펴보면 n-octanol/water 분배계수(Log Pow)는 2.8로 중간 극성인 중성 화합물이며, 녹는점은 135.5 - 136.8°C이고, 분자량은 311.4(C17H17N3OS)인 흰색의 분말형태로 다양한 유기용매에 잘 녹으나(acetone 250g, acetonitrile 86.1g, dichloromethane 330g, ethyl acetate 105.7g, methanol 43.1g, toluene 40.1g·L-1), 물에 대한 용해도는 7.8mg·L-1 정도로 극히 낮고, 증기압은 3.4 × 10-4 mPa 수준이다(EC, 2003).
살균제 fenamidone은 국내 식품공전 다성분 잔류농약분석법 4.1.2.2법에 수록되어 있고, Solid Phase Extraction(SPE) 정제 후 gas chromatography-electron capture detector(GC-ECD) 혹은 nitrogen phosphorous detector(NPD)로 분석하는 방법이 제시되어 있고(Ministry of Food and Drug Safety, 2012), 국외에서는 LC/MS를 이용한 QuEChERS 방법을 적용한 다성분 분석법이 보고된 바 있다(Angioni, 2012). 그러나 실제 다성분 분석법은 수백 종의 농약을 대상으로 동시에 분석하여야 하므로, 다성분 분석법의 특성상 특정 분석 대상 농약성분 전체에 대한 최적화가 되어 있지 않은 실정이다. 특히 fenamidone의 경우 SPE 정제의 한계성으로 인해 재현성 및 정제도가 극히 떨어지고, 분자구조 내에 imidazolinone ring을 포함하고 있어 휘발성이 극히 낮고 고온에서 열분해의 가능성이 극히 높기 때문에 gas liquid chromatography(GLC) 분석 시 정량성이 떨어지는 문제가 있다. 그러나 이러한 문제점을 해결하기 위하여 high performance liquid chromatography(HPLC)를 이용한 fenamidone의 분석조건 확립 및 작물별 회수율이 체계적으로 검토된 바는 없다.
최근 각국의 농산물 수출입 교역이 증가되는 시점에서 잔류농약의 정확한 분석 및 평가는 매우 중요한 요소로 작용하나, 잔류농약의 검사 체계에 포함되어 있지 않거나, 정확한 정량적 분석법이 없는 농약에 대해서는 잔류량 평가 자체가 불가능하므로 향후 많은 사회적 문제점으로 대두될 수 있을 것이다.
따라서 본 연구는 현행 식품공전 상에 수록된 imidazolinone계 살균제인 fenamidone의 분석방법을 개선하여 국내 및 수출입 농산물의 잔류농약 검사에 활용 가능한 분석법을 개발하고자 수행되었다.
재료 및 방법
시험 재료
국내 식품의 농약 잔류허용기준(Ministry of Food and Drug Safety, 2014) 중 fenamidone의 사용이 등록되어 있고, Codex의 잔류분석법 대상 대표 농산물군(Codex Alimentarius Commission, 2003) 및 국내 소비량이 많은 원예작물 중 사과, 고추, 배추 및 오이를 대상으로 전 생육기간 중 fenamidone을 처리하지 않은 시료를 시험재료로 사용하였다. 사과는 대구광역시 소재 경북대학교 내 시험포장에서 재배한 ‘후지’(Malus domestica Borkh ‘Fuji’) 품종을 10월 31일에, 고추는 ‘슈퍼마니따’(Capsicum annuum L. ‘Super manita’) 품종을 7월 20일에 수확하였다. 배추는 ‘춘광’(Brassica campestris L. ‘Choongwang’) 품종을 강원도 삼척에 위치한 독농가에서 재배하여 7월 25일 수확하였고, 오이는 ‘백다다기’(Cucumis sativus L. ‘Baekdadagi’) 품종을 경북 상주시에 위치한 독농가에서 재배하여 9월 15일에 수확한 후 시험재료로 사용하였다. 수확된 각 분석시료는 - 80°C에 동결 보관하였고, 각각의 시험재료들은 해동 후 식품공전 검체 처리방법(Ministry of Food and Drug Safety, 2012)에 따라 전처리한 후 사용하였다.
Fenamidone은 순도 98.0%의 분석용 표준품을 Dr. Ehrenstorfer GmbH(Germany)로부터 구입하여 사용하였다. 표준품의 stock solution은 methanol에 녹여 1,000mg·L-1의 농도로 조제하여 - 20°C의 냉동고에 보관하고, 필요 시마다 methanol로 희석하여 사용하였다. Florisil(60 - 100mesh)은 J.T. Baker(USA)로부터 구입하여 130°C에서 12시간 이상 가열, 활성화하여 사용하였다. Acetone, n-hexane, dichloromethane, ethyl acetate, methanol 및 acetonitrile은 잔류분석용을, deionized water는 HPLC용(J.T. Baker, USA)을, 기타 유기용매 및 무기시약은 시약특급 또는 잔류분석용을 사용하였다. 농축기는 Eyela NE-1000 SW(Tokyo, Japan)를 사용하였고, 시료의 마쇄 및 균질화는 고속 분쇄기(Ultra-Turrax T-25, IKA, Wilmington, NC, USA)를 이용하였다. 모든 실험은 25°C 조건이 설정된 실험실에서 수행하였으며, 사용된 초자기구들은 정기적으로 보정을 받은 기구들을 사용하였다.
HPLC-UVD/MS 기기분석 조건
Fenamidone은 분자구조 내에 imidazolinone ring을 포함하고 있어 휘발성이 낮고, 고온에서 열분해 가능성이 높기 때문에 HPLC 분석법을 적용하였다. Fenamidone 분자 내 conjugation system에 착안하여 비교적 장파장의 자외흡광이 예상되므로 검출기는 자외흡광검출기(ultra violet detector: UVD)를 이용하였다. UVD를 장착한 HPLC는 Agilent 1200 series(Wilmington, DE, USA)를 이용하였고, 분리용 칼럼은 YMC-Pack Pro C18 RS(4.6 × 250mm, 5μm, YMC Co, Kyoto, Japan)를 사용하였다. 잔류분의 재확인을 위한 liquid chromatography/mass spectrometry(LC/MS)분석에는 Agilent 6110 Quadrupole LC/MS (Wilmington, DE, USA)를 사용하였으며, 각각의 분석조건은 Table 1과 Table 2와 같다.
Table 1. HPLC-UVD operating parameters for the analysis of fenamidone
Table 2. LC/MS operating parameters for the confirmation of fenamidone
표준검량선 및 분석정량한계(Limit of quantitation, LOQ)
Fenamidone의 stock solution을 희석하여 0.05 - 10mg·L-1의 농도가 되도록 농도별 표준용액을 조제하고, 각 20μL씩 HPLC에 주입하여 분석된 peak의 면적을 기준으로 표준검량선을 작성하였다. 또한, 분석기기의 재현성(reproducibility)을 검증하기 위해 0.5mg·L-1의 fenamidone 표준용액을 HPLC에 15번 연속 주입, 크로마토그램 상의 retention time(Rt.) 및 peak area의 변이를 비교 평가하였다.
분석법의 정량한계는 각 무농약 시료에서 간섭물질이 존재하지 않음을 확인한 후, 분석기기의 정량한계와 시료량 및 분석과정 중의 농축배율을 계산하여 아래의 계산식에 의해 산출하였으며, 동일 수준으로 fenamidone을 처리한 회수율 시험으로 재확인하였다.
LOQ(mg·L-1) = [기기 정량한계(ng) / 주입량(μL)] × [시료용액(mL) / 시료량(g)]
시료 추출 및 분배
각 시료 25g에 acetone 100mL를 가하고 고속 분쇄기 상에서 2분간 고속마쇄(27,237 × g)로 추출하였다. 추출물을 여과지(Toyo No. 6, Japan)가 장착된 Buchner funnel 상에서 여과하고 시료 및 호모게나이저 컵을 여분의 acetone 40mL로 씻어 여과액과 합하였다. 합친 추출액을 1L 용량의 분액여두에 옮기고 포화식염수 50mL와 증류수 450mL를 첨가한 뒤 dichloromethane으로 50mL씩 2회 분배 추출하였다. 합친 dichloromethane 추출액을 무수 sodium sulfate에 통과시켜 탈수한 후 40°C에서 감압 농축 및 건고하였다. 시료의 잔류물은 n-hexane 10mL에 재용해하여 florisil 흡착 크로마토그래피에 직접 공시하였다.
Florisil 흡착 크로마토그래피
내경 1.5cm, 길이 40cm의 유리 칼럼에 활성화시킨 florisil 10g을 건식 충전한 후, 3g의 무수 sodium sulfate를 그 위에 첨가하였다. 칼럼에 n-hexane 50mL를 가하여 상단에 소량의 n-hexane이 남을 정도로 유출시켜 버린 후 n-hexane 10mL에 녹인 시료 용액을 가하여 약 3mL·min-1의 유속으로 유출시켰다. 충전제 표면이 노출되기 직전 n-hexane/dichloromethane 혼합용액(50/50, v/v) 100mL를 용출시켜 버린 후 재차 n-hexane/ethyl acetate 혼합용액(85/15, v/v) 150mL를 용출시켜 받았다. Fenamidone이 용출된 분획은 40°C에서 감압 농축, 건고하고 잔류물을 acetonitrile/water 혼합용액(65/35, v/v) 10mL에 재용해하여 HPLC로 분석하였다.
Fenamidone의 회수율 검정
본 연구에서 확립한 fenamidone 잔류분석법의 효율 및 신뢰성을 검증하기 위하여 실제 시료에 대한 회수율 시험을 수행하였다. 즉, 마쇄한 각 대표 무농약 시료 25g에 LOQ, LOQ의 10배 및 50배가 되도록 fenamidone 표준용액을 각각 3반복으로 처리한 다음 상기 분석과정을 수행하여 회수율과 분석오차를 측정하였다.
결과 및 고찰
HPLC 분석조건의 확립
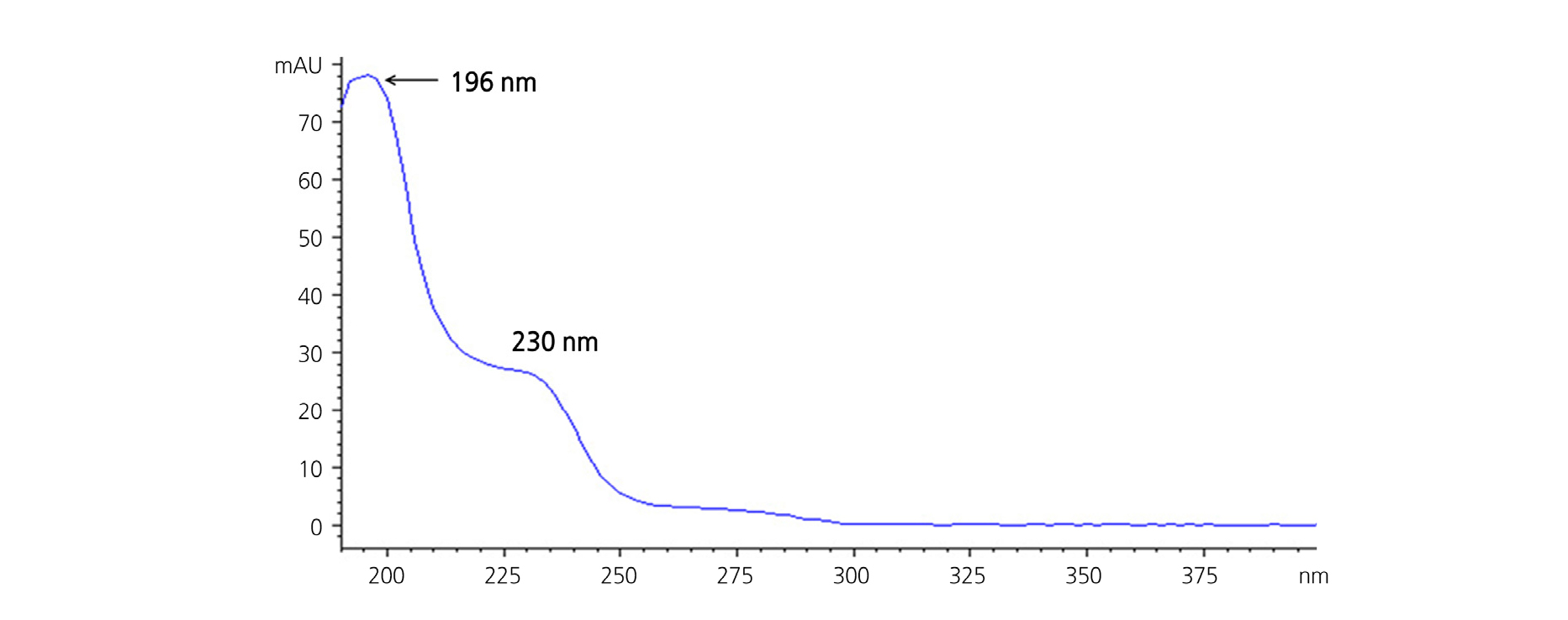
Fenamidone의 최적 HPLC 분석파장을 선정하기 위하여 methanol에 용해한 5mg·L-1의 표준용액을 on-line HPLC/DAD를 이용하여 190 - 400nm 범위에서 최대흡수파장(λ max)을 조사하였다. 흡수파장은 196nm 및 230nm에서 관찰되었으며, 흡광계수는 196nm, 230nm 순으로 낮아지는 양상을 나타내었다(Fig. 2). Fenamidone의 흡수파장 중 196nm는 흡광계수가 가장 높아 분석 감도는 높게 관찰되나 시료 중 함께 추출되는 메트릭스 성분의 흡광 및 용매의 자외선 흡광(UV cut-off)이 예상되므로 상대적으로 시료 추출물 및 이동상 용매에 의한 간섭 정도가 낮아 fenamidone 분석의 선택성이 196nm보다 우수한 장파장인 230nm를 검출파장으로 설정하였다.
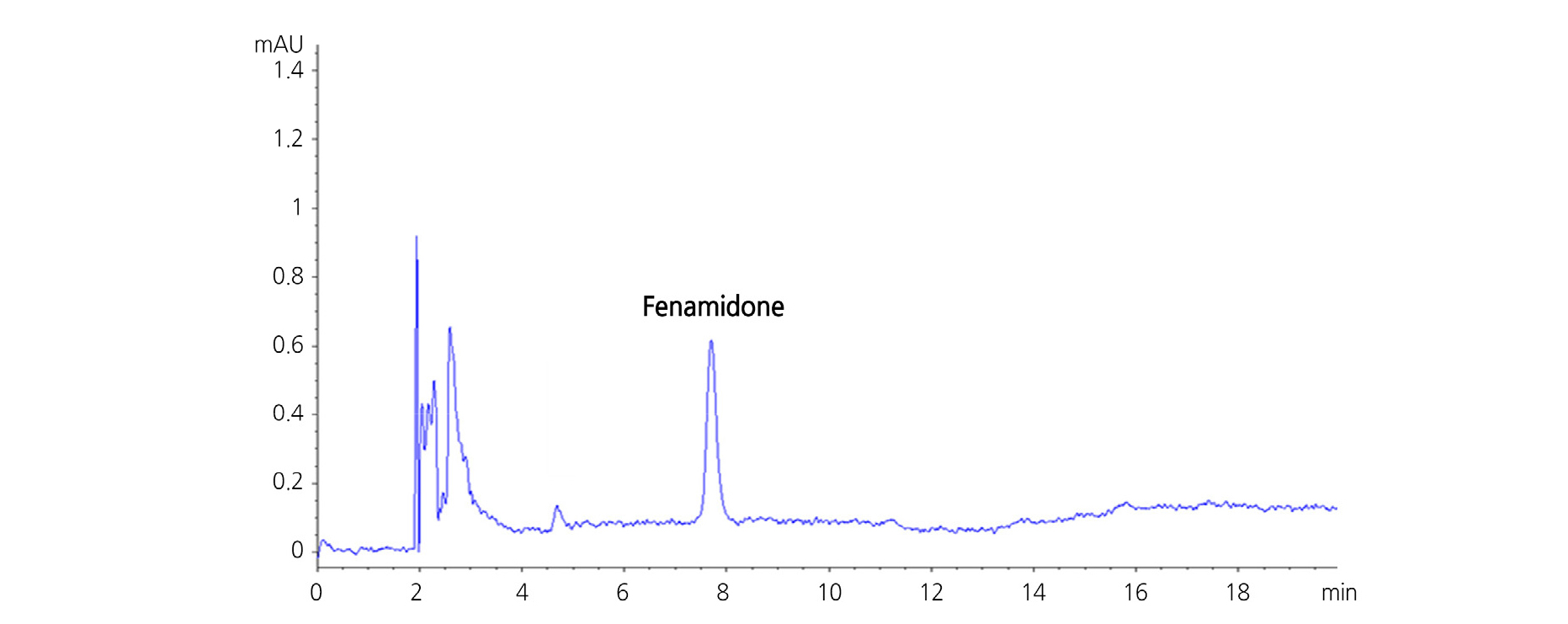
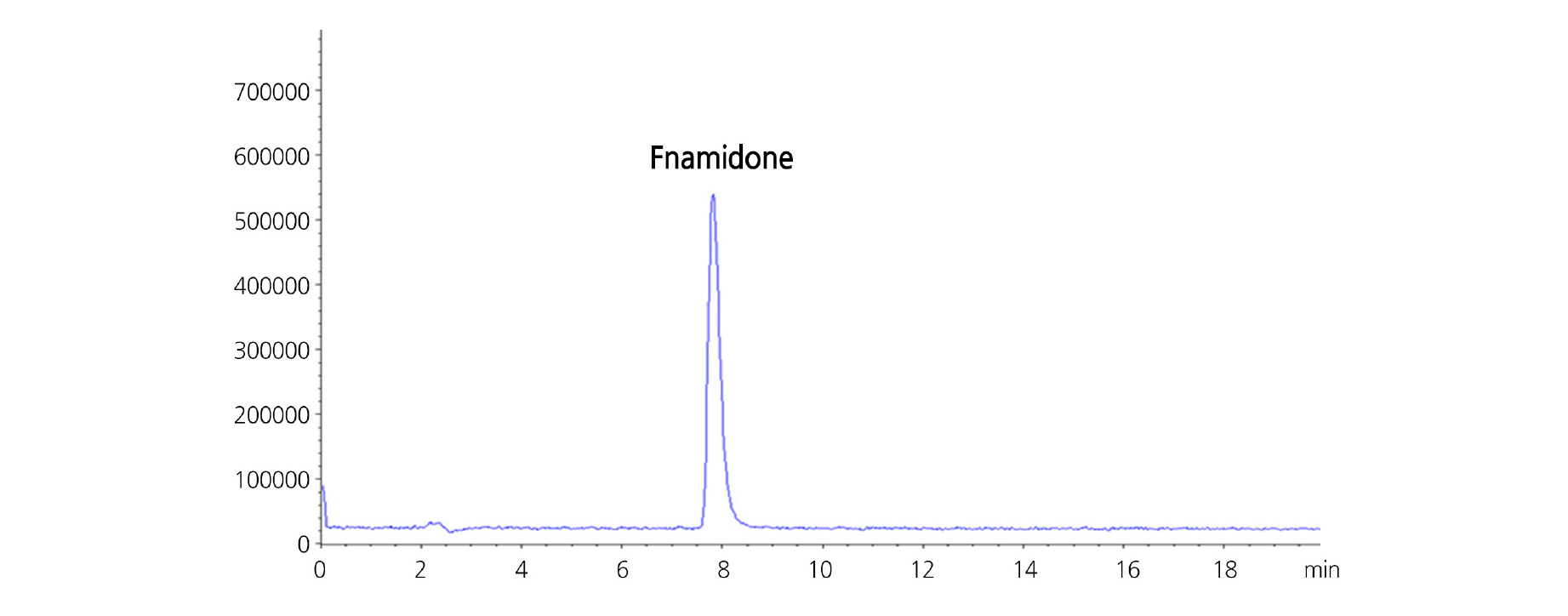
HPLC 분석의 분리용 칼럼은 C18계열의 YMC-Pack Pro C18 RS를 이용하였고, 이동상은 fenamidone이 해리가 되지 않는 중간극성 화합물임을 감안하여 acetonitrile 수용액을 사용하였다. 이동상 중 acetonitrile의 농도를 달리하여 머무름시간 및 peak의 이론단수 등을 검토한 결과, 등용매용리(isocratic elusion) 조건에서 acetonitrile/water(65/35, v/v) 혼합용액이 머무름시간과 분리도 측면에서 가장 적합한 양상을 나타내었으며(Fig. 3), 이때 fenamidone의 머무름시간은 7.7분이었다. 분리능과 감도를 증대시키기 위하여 용매구배법(gradient elution)을 사용할 수 있으나, 이 경우 분석시간이 지연될 수 있고 머무름시간의 재현성이등용매용리 조건에 비해 상대적으로 열등할 수 있다. 본 분석법의 개발 목적은 시료 입수 후 단시간 내에 분석 작업이 수행되어야 하는 일상적 공정 분석용이므로 분석법의 안정성 측면에서 보다 유리한 등용매용리 조건을 선정하였다.
기기분석 시 검출한계는 크로마토그램에서 peak로 검출할 수 있는 한계농도를 의미하는데, 크로마토그램 상에서 signal/ noise(S/N)비가 3 이상을 나타내는 성분의 농도로 정의되나 신뢰성이 떨어지므로 검출 유무만을 판정하며 명확한 수치화는 어렵다. 한편, 정량한계는 크로마토그램의 해석 시 신뢰성이 확보되어 분석결과를 수치화할 수 있는 한계농도로써, 크로마토그램 상에서 검출된 peak의 S/N의 비가 10 이상(검출한계의 3배 이상)을 나타내는 성분의 농도를 의미한다(Fong et al., 1999; Miller, 2005). Table 1의 HPLC 분석 조건에서 fenamidone 표준용액을 분석하여 S/N비를 계산한 결과, 기기 상의 정량한계(S/N≥10)는 2ng 수준이었다. 한편, 기기분석의 안정성 평가를 위해 0.5mg·L-1 농도의 표준품을 15번 반복 주입 분석하여 머무름시간 및 peak 면적의 변이계수(CV, %)를 조사하여 분석 재현성을 평가하였다. 그 결과, 두 크로마토그래피 척도 모두에서 최대 1.56% 미만의 오차를 나타내어 기기 분석 시 안정적이고 재현성 있는 분석을 수행할 수 있음을 확인하였다(Table 3).
Table 3. Reproducibility of retention time and peak area of fenamidone using HPLC
| Parameter | Retention time (min) | Peak Area (mAU) |
| Minimum | 7.688 | 34.6 |
| Maximum | 7.713 | 36.4 |
| Mean | 7.706 | 35.5 |
| SDz | 0.02 | 0.55 |
| CVy (%) | 0.24 | 1.56 |
yCoefficient of variance.
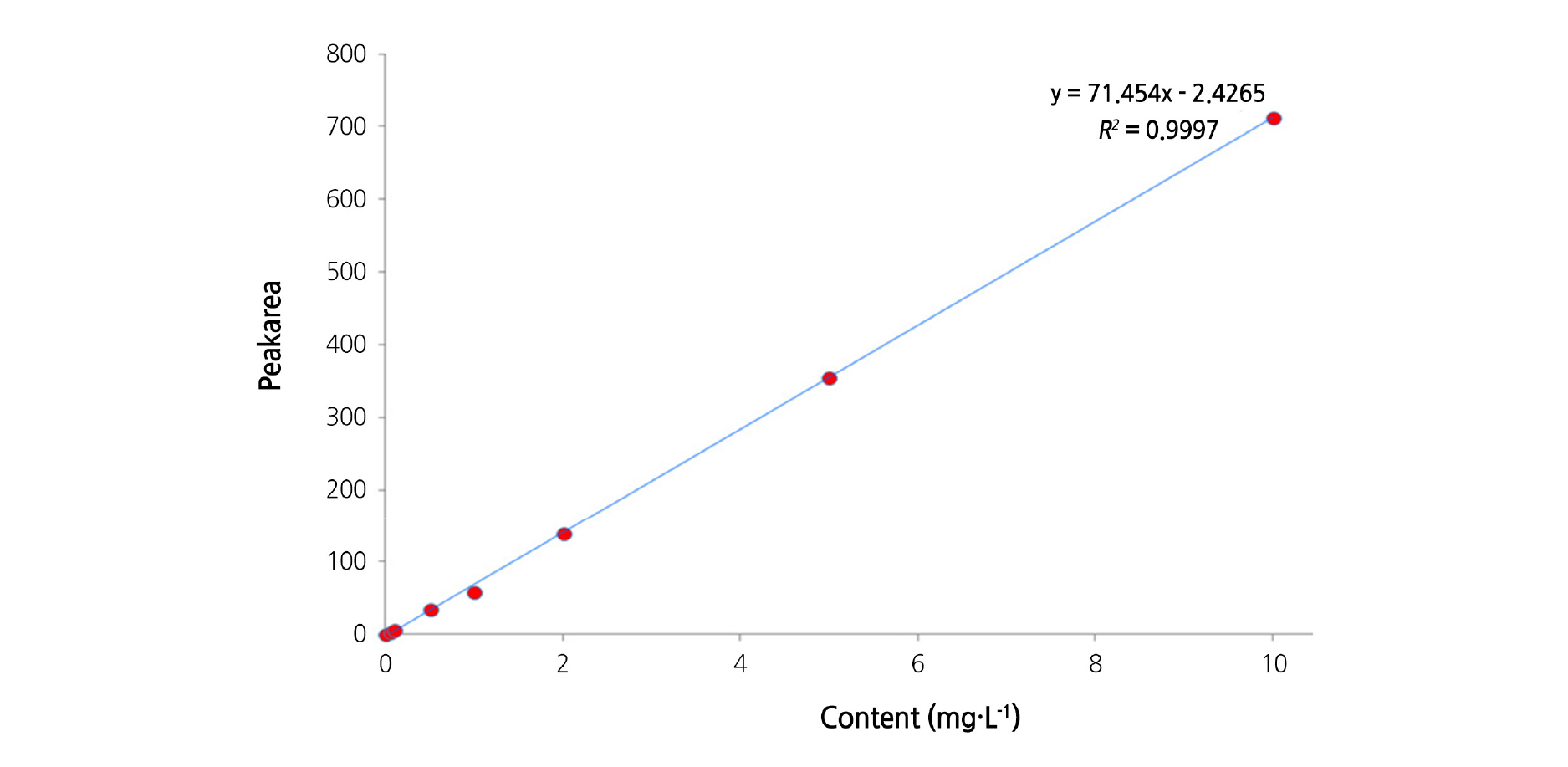
한편, fenamidone의 농도별 표준용액(0.05 - 10mg·L-1) 20μL를 HPLC에 주입, 분석하여 얻은 검량선의 회귀방정식은 y= 71.4537x-2.4265(R2=0.999**)으로 우수한 직선성을 나타내었다(Fig. 4). 즉, fenamidone은 기기 정량한계의 1/2 수준인 1ng에서부터 그 200배인 200ng까지의 표준검량선에 대한 회귀계수가 R2=0.999** 이상으로 정량의 직선성이 검정되었다. 이는 Beer’s law 확인을 통하여 1ng에서부터 200ng 농도 범위까지의 시료 중 잔류량을 비례적으로 산출하였다.
시료 추출 및 분배
각각의 시료로부터 fenamidone 성분을 추출하기 위한 용매로는 acetone을 사용하였다. Acetone은 다양한 농약의 추출에 보편적으로 사용되는 표준적 용매로써 이미 많은 연구자들에 의하여 농약 추출에 그 효율과 재현성이 인정된 바 있다(Ahn et al., 2014). 농산물 추출액으로부터 대상 성분과 함께 추출되는 방해물질을 1차적으로 제거하기 위한 조정제법으로는 액-액 분배법을 사용하였다. 즉, 수용성 유기용매 추출액을 다량의 포화식염수/증류수로 희석한 후 직접 비극성 용매로 분배 추출하는 방법을 사용하였는데, 이는 United State Food and Drug Administration(US FDA)법이나 Association of Analytical Communities (AOAC)법에서 중간극성에서 비극성 사이의 농약 성분에 대하여 보편적으로 사용되며, 번거로운 추출액의 농축과정을 생략할 수 있는 장점이 있다(AOAC, 2000; Lee et al., 2008). 액-액 분배법의 분배용매로는 n-hexane, 2종의 n-hexane/dichloromethane 혼합액, dichloromethane 등 4종을 공시, 대상 성분의 분배효율을 조사하였다(Table 4). 대상 성분의 액-액 분배조건에 따른 분배효율을 조사한 결과, n-hexane 용액 100mL로 분획하였을 때 fenamidone의 회수율은 68.3% 수준이었으며, n-hexane/ dichloromethane 혼합액(80/20, v/v) 100mL로 분획하였을 때 회수율은 87.3% 수준, n-hexane/dichloromethane 혼합액(20/80, v/v) 100mL로 분획하였을 때는 91.5%, dichloromethane 50mL로 2회 반복하여 분획하였을 때의 회수율은 94.9%를 나타내어 분배용매 Ⅳ의 dichloromethane 50mL로 2회 반복하여 분획을 수행하는 액-액 분배조건을 fenamidone의 최종 분배용매로 선정하였다.
Table 4. Efficiency of liquid-liquid partition of crude extract by different solvents for fenamidone
| Compound | Recovery ratio (%)z | |||
| PartitionⅠ | PartitionⅡ | PartitionⅢ | PartitionⅣ | |
| Fenamidone | 68.3 ± 0.4y | 87.3 ± 0.3 | 91.5 ± 0.3 | 94.9 ± 1.0 |
yMean ± standard deviation of triplicate samples.
Dichloromethane 액-액 분배과정에 의하여 시료 중에 포함된 상당량의 비극성 및 기타 방해물질이 제거될 것으로 기대되나, 일부 유지 성분은 dichloromethane 층으로 대상 성분과 함께 분배되기 때문에 제거되지 않는다. 이러한 유지 성분은 기기분석 시 치명적 간섭, 분리용 column을 분리능 저하 및 기준선의 심각한 변화(baseline shift)를 초래하므로 반드시 제거해야 할 간섭물질이다. 본 연구의 대상 시료 중에는 고 유지 시료가 포함되어 있지 않으나, 추후 이 분석법의 활용 시 고 유지시료의 적용을 대비하여 n-hexane/ acetonitrile 분배법을 추가로 공시하였다(US FDA, 1999; AOAC, 2000). Table 5에 나타낸 바와 같이 미리 n-hexane으로 포화시킨 acetonitrile로 3회 분배하였을 때 fenamidone의 전량 회수가 가능하였으므로, 유지 및 비극성 간섭물질의 제거를 위한 n-hexane/acetonitrile 분배법은 분배조건 Ⅱ로 설정하였다. 본 연구에 사용된 대부분의 시료는 유지 함량이 낮은 비유지 시료로 분류되므로 실제 본 연구의 회수율 검증에서는 비극성 유지 성분 및 불순물의 양이 매우 작고 크로마토그램 상에서 그 정제 효과 또한 미미하였으므로 n-hexane/ acetonitrile 분배과정을 생략하였다.
Table 5. Efficiency of n-hexane/acetonitrile partition for fenamidone
| Compound | Recovery ratio (%)z | |
| PartitionⅠ | PartitionⅡ | |
| Fenamidone | 81.6 ± 1.5y | 95.5 ± 0.4 |
yMean ± standard deviation of triplicate samples.
Florisil 흡착 크로마토그래피
각 시료들에 함유된 fenamidone의 분석 시 상기 액-액 분배과정을 통해 상당량의 불순물 및 비극성 간섭물질들이 제거되었을 것으로 판단되나, 작물에 따라 시료로부터 유래되는 다양한 기타 불순물이 존재하므로, 추가적인 정제과정이 필요할 것으로 판단되어 흡착크로마토그래피에 의한 정제법을 검토하였다. 흡착크로마토그래피는 잔류농약 분석 시 가장 많이 이용하는 방법으로, 흡착제로는 silica gel, florisil 및 alumina 등이 많이 사용된다. 이 중 florisil은 색소와 지방의 제거가 뛰어나 미국의 FDA(1999)나 AOAC(2000) 등에서 가장 많이 사용하는 방법이다. 본 연구에서도 florisil을 흡착제로 선정하였으며, 용매의 극성 조절을 위해 n-hexane/dichloromethane 및 n-hexane/ethyl acetate 혼합용액의 용매체계를 사용하여 최적화하였다(Table 6). Florisil 흡착크로마토그래피용 용매의 다양한 극성 조절을 이용하여 fenamidone의 회수율을 조사한 결과, n-hexane/ dichloromethane 혼합액(50/50, v/v) 100mL로 pre-washing한 후, n-hexane/ethyl acetate 혼합액(85/15, v/v) 150mL로 용출할 경우 fenamidone 성분의 회수율이 90.8%로 우수하였으며, ethyl acetate의 비율을 높여 용출용매의 강도를 높여도 회수율은 개선되지 않았다. 따라서 florisil 흡착크로마토그래피법을 이용한 간섭물질 제거를 위한 추가적인 정제법은 상기의 방법을 적용하였다.
Table 6. Elution profile of fenamidone on Florisil column
yn-hexane/dichloromethane (v/v).
xPre-washed with 100 mL of n-hexane/dichloromethane, and then eluted n-hexane/ethyl acetate (v/v).
Fenamidone의 분석정량한계 및 회수율
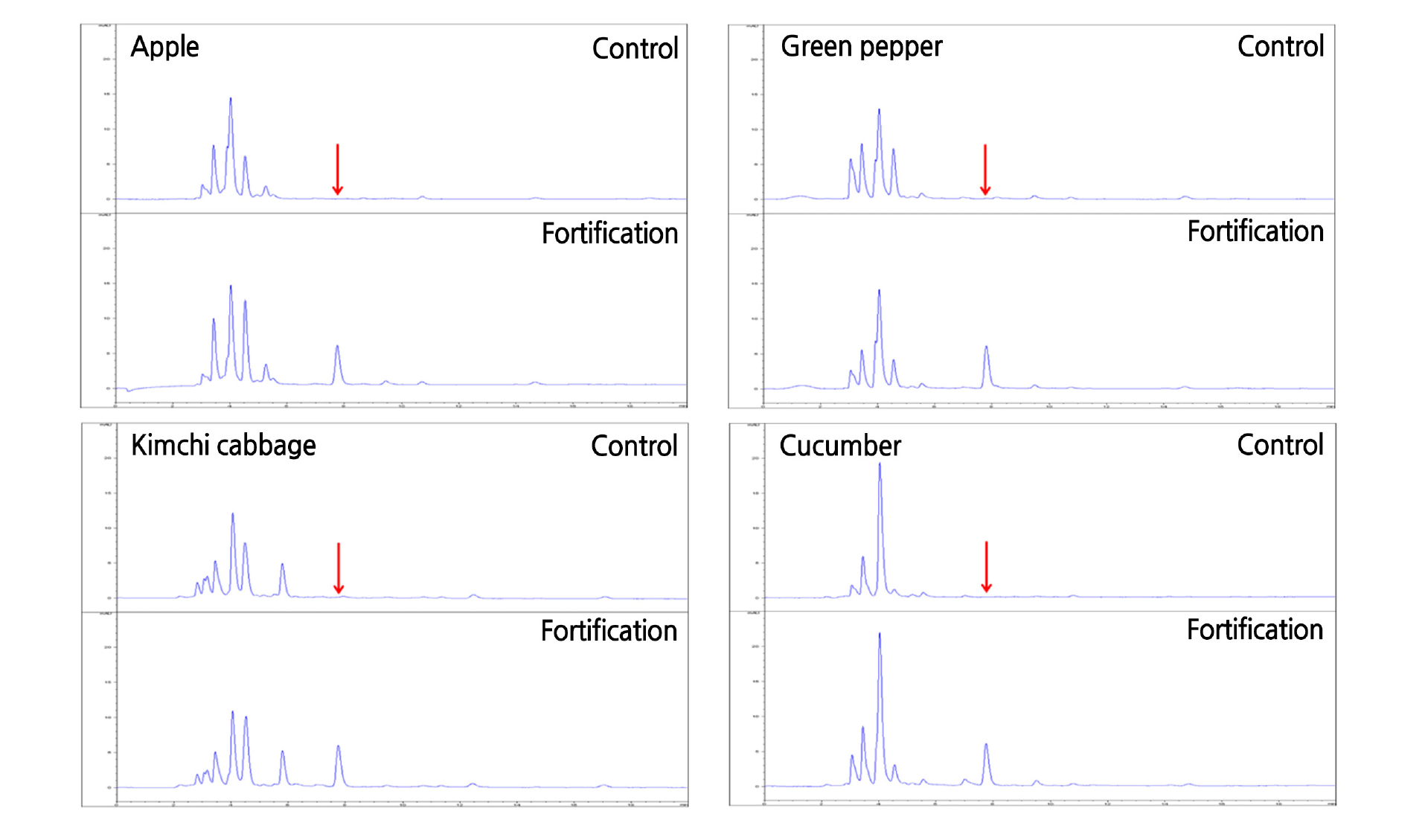
본 연구에서 확립한 시료 추출 및 정제, 그리고 기기분석 과정을 각 무농약 시료에 적용한 결과는 Fig. 5와 같다. 무농약 원예작물의 최종 시료용액에서 대상농약과 동일한 머무름시간에 간섭물질이 존재하지 않음을 확인하였고, 분석기기의 정량한계(LOQ)와 시료량, 그리고 분석과정 중의 농축배율을 계상하여 분석법의 정량한계를 산출하였다. 본 연구에서 무농약 시료에서 간섭물질이 존재하지 않음을 확인한 후 산출된 fenamidone의 정량한계는 0.04mg·kg-1이었으며, 국제기준인 Codex Alimentarius Commission(Codex, 2003) 및 식품공전 잔류농약분석법 실무 해설서(Lee, 2017)에서 권장하는 잔류농약분석법 기준인 0.05mg·kg-1 이하 또는 허용기준의 1/2 이하의 정량한계 기준에 적합하였다. 각각의 무처리 시료에 fenamidone 표준용액을 정량한계, 정량한계의 10배 및 50배의 농도가 되도록 첨가하고, 상기 확립된 분석방법에 의하여 대표 농산물을 3반복으로 분석하여 회수율을 조사한 결과, 정량한계 수준에서는 87.9 - 93.9%, 정량한계 10배 수준에서는 89.5 - 97.9%, 정량한계 50배 수준에서는 85.5 - 96.9%의 양호한 회수율을 보였고, 재현성도 양호하여 분석오차는 최대 6.0%로 조사되었다. 따라서, 처리농도수준 및 원예작물의 시료 종류에 관계없이 잔류분석기준인 회수율 70 - 120% 범위와 분석오차 10% 이내를 충족하였다(Table 7). 따라서 본 시험에서 확립된 fenamidone의 분석법은 국내·외 원예작물의 잔류농약 분석 및 검사에 충분히 적용 가능함을 확인하였다.
Table 7. Recovery ratio of fenamidone with different horticultural crops
yLimit of quantitation.
xMean ± standard deviation of triplicate samples.
LC/MS를 이용한 잔류분의 재확인
개발된 분석법의 신뢰성을 확보하기 위하여 LC/MS에 의한 재확인 과정을 수행하였다. LC/MS 분석 시 분석대상 성분의 분자구조로부터 유도되는 분자이온과 주요 fragment ion을 확인함으로써 보다 신뢰성 있는 정성 확인이 가능하다는 장점이 있다(Kwon et al., 2008).
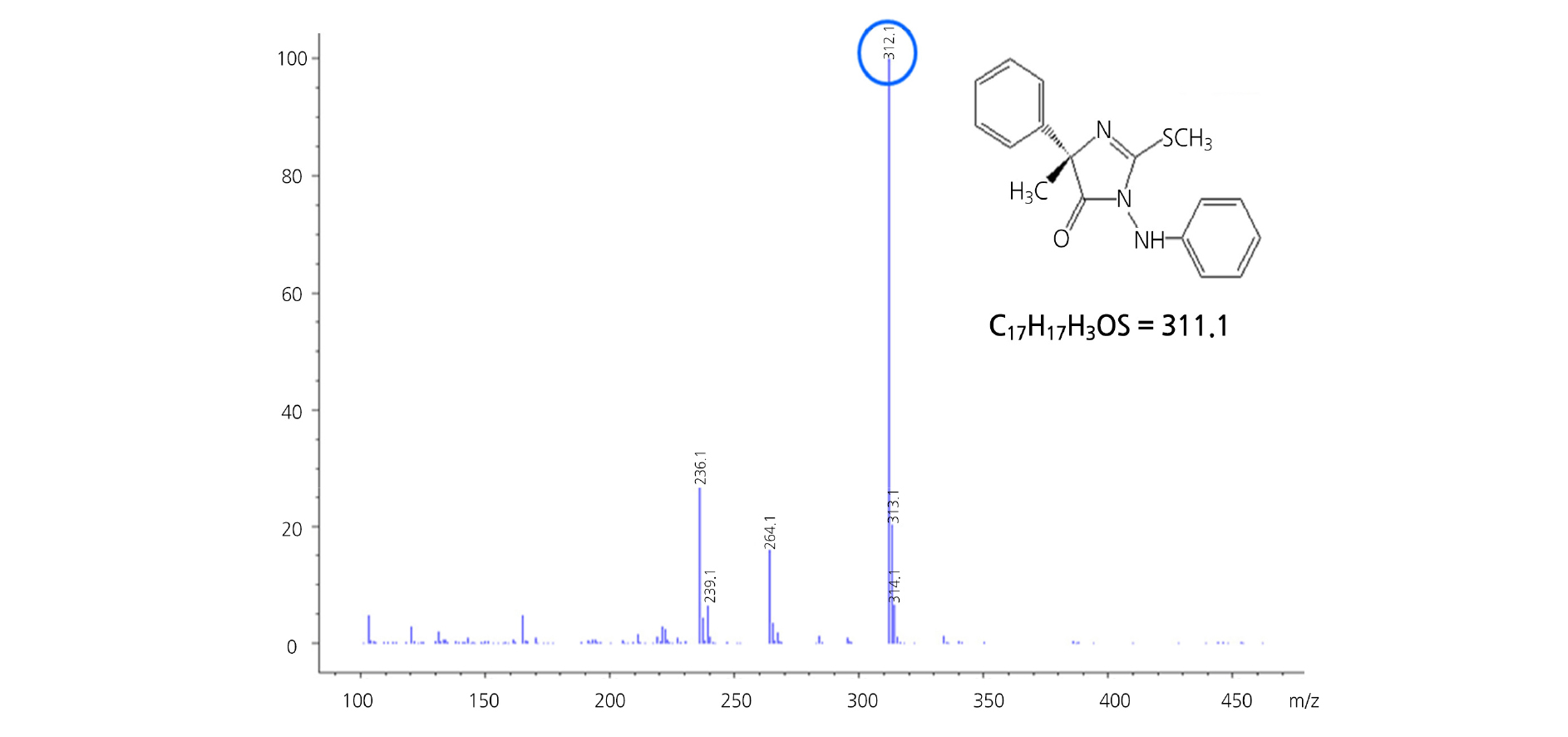
Fenamidone 성분의 분자이온화를 향상시키기 위하여 HPLC 분석에 이용된 이동상 용매 중 증류수에 10mM ammonium acetate를 첨가하여 분석을 실시하였고, Fig. 6과 Fig. 7에 나타낸 total-ion chromatogram 및 mass spectrum으로부터 fenamidone은 electrospray ionization positive ion 조건에서 용이하게 protonation되어 [M+H]+를 형성함을 알 수 있었다. 본 연구에서 fenamidone의 [M+H]+ peak가 base peak로 나타나므로 selected-ion monitoring(SIM)용 ion으로는 [M+H]+인 m/z=312.1 이온만을 이용하여도 충분한 정성적 확인이 가능하였다(Ardrey, 2003; McLafferty and Turecek, 1993).
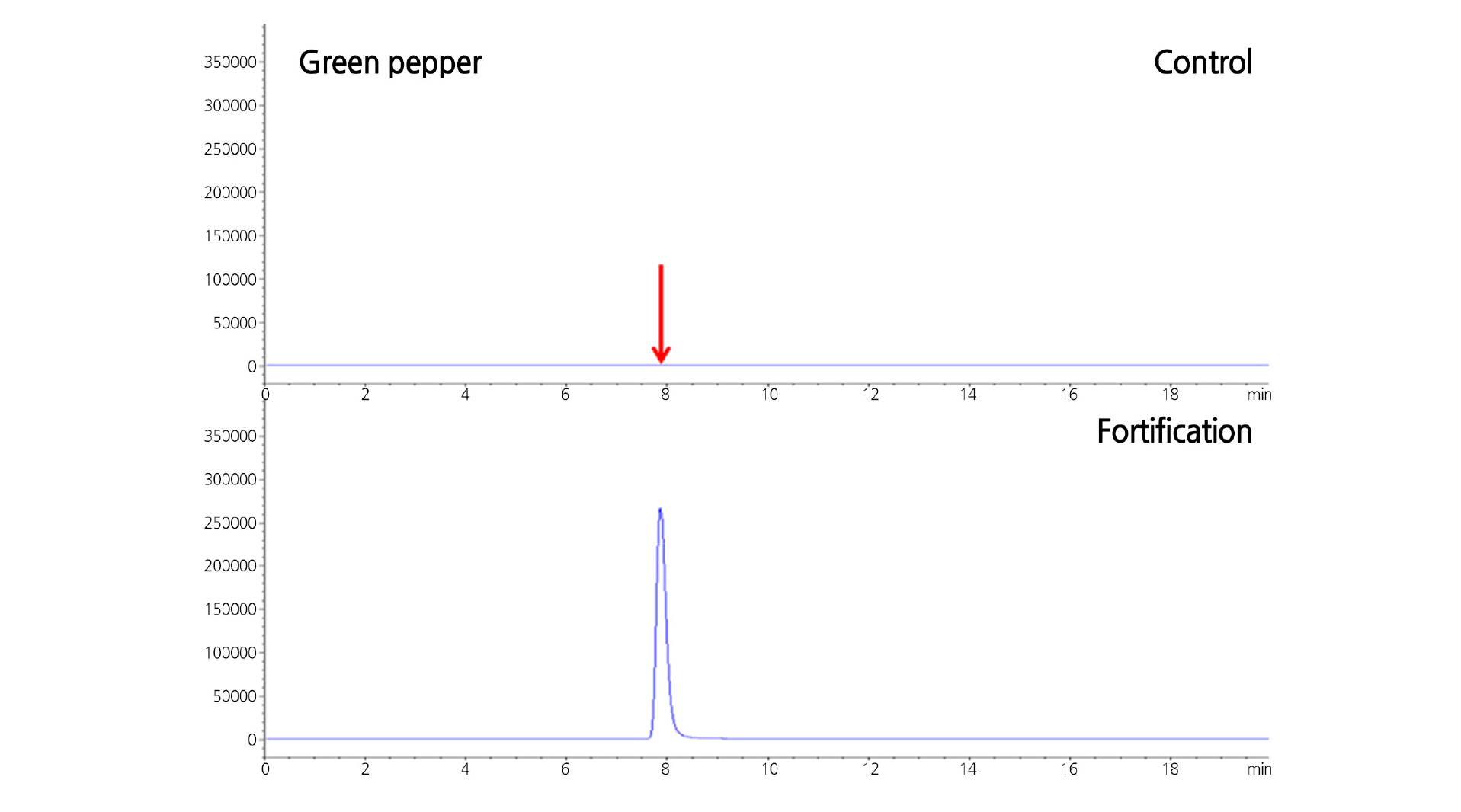
Fig. 8은 본 실험에 사용된 시료 중 고추를 대상으로 fenamidone의 잔류분을 재확인한 SIM chromatogram이며, 모든 원예작물의 무처리 시료에서는 대상 농약성분의 peak가 전혀 관찰되지 않았고, 인위 첨가된 시료에서는 동일한 머무름 시간대에 정확하게 fenamidone의 잔류분만을 확인할 수 있었다. 따라서 본 연구에서 사용한 LC/MS의 SIM조건을 이용할 경우에도 HPLC-UVD를 이용한 정량법과 더불어 fenamidone 잔류분의 추가적 정성분석법으로 사용할 수 있을 것으로 판단되었다.
이상의 결과를 종합해 보면, C18 칼럼을 이용한 HPLC 분석 시 불순물의 간섭은 없었으며, 사과, 고추, 배추 및 오이를 포함한 4종의 대표 원예작물 중 fenamidone의 정량한계(LOQ)는 0.04mg·kg-1이었다. 4종의 대표 원예작물에 대한 회수율은 85.5 - 97.9%였으며, 원예작물 시료 및 처리수준에 관계없이 10% 미만의 분석오차를 나타내어 잔류분석기준 이내를 충족하였다. 본 연구에서 확립된 imidazolinone계 살균제인 fenamidone의 잔류 분석법은 검출한계, 회수율 및 분석오차 면에서 국제적 분석기준을 충족할 뿐만 아니라, LC/MS SIM을 이용한 잔류분의 재확인 과정의 결과를 종합해 볼 때 분석과정의 편이성 및 신뢰성이 확보된 잔류농약 분석법으로 사용이 가능할 것으로 판단된다. 그러므로 fenamidone의 경우 분자구조 내에 imidazolinone ring을 포함하고 있어 휘발성이 극히 낮고 고온에서 열분해의 가능성이 극히 높기 때문에 기존 국내 식품공전의 방법인 gas liquid chromatography(GLC) 분석 시 정량성이 떨어지는 문제가 있으므로 잔류 검사의 필요성이 있을 경우 본 연구에서 검토된 HPLC 혹은 LC/MS법을 이용한 단성분 분석법이 유용할 것으로 판단된다.