서 언
재료 및 방법
실험재료
1-MCP 및 AVG 처리 및 저장
과실 특성 평가
Ethylene 및 CO2 발생량 조사
RNA 분리 및 Real-Time PCR
통계처리
결과 및 고찰
처리에 따른 저장 중 과실 특성 변화
Ethylene 과 CO2 발생량 변화
과실 성숙 및 에틸렌 합성 관련 유전자 발현 분석
서 언
국내의 주요 과종인 복숭아 과실의 성숙은 호르몬 합성을 포함한 여러가지 요인들에 의해 조절된다(Hiwasa et al., 2003). 복숭아는 호흡급등형 과실로 에틸렌에 민감하게 반응하고, 에틸렌 생합성과 관련한 기작을 통해 과실의 성숙을 조절한다(Lelièvre et al., 1997; Alexander and Grierson, 2002; Rasori et al., 2002). 에틸렌은 과실의 성숙 과정에서 세포의 작용 부위에 결합하여 성숙과 노화를 촉진하고(Burg and Burg, 1967; Lelièvre et al., 1997), 성숙과 ‧ 관련된 ‧ 생화학적 변화를 유도하며(Mathooko et al., 2001; Ruperti et al., 2001), 연화를 빠르게 진행시킴으로써 저장성의 약화를 초래한다(Choi, 2005).
1-Methylcyclopropene(1-MCP)는 에틸렌의 작용을 억제하는 유용한 물질로 과실과 채소의 보구력 향상을 위한 연구에 많이 이용되고 있다(Lulie, 2007; Watkins, 2008). 1-MCP는 에틸렌과 유사한 가스의 형태로 되어 있어 에틸렌 수용체와 특이적으로 결합하여 에틸렌의 작용을 억제하고 연화를 지연시키는데 효과가 있다고 알려져 있다(Sisler and Serek, 1997; Watkins, 2008).
Aminoetoxyvinylglycine(AVG)는 과실을 포함한 식물체에서 에틸렌 생합성을 억제하는 것으로 보고되어 있다(McGlasson et al., 2005; Yuan and Li, 2008). ‘리테인’이라는 상품명으로 사과 등에서 과실의 낙과 방지 또는 저장성 향상의 목적으로 사용되는 AVG는 에틸렌 생합성 과정에서 ACC를 합성하는 ACC synthase의 작용을 억제함으로써 에틸렌 생합성을 억제하여 고품질의 과실을 생산할 수 있다(Yang and Hoffman, 1984; Halder-Doll and Bangerth, 1987).
복숭아는 성숙 과정 중 exopolygalacturonase(exoPG), endopolygalacturonase(endoPG) 등의 다양한 효소의 활성이 증가하여 과실의 연화가 진행된다(Pressey and Avants, 1973; Brummell et al., 2004; Hayama et al., 2006). 또한 품종에 따라 차이가 있기는 하지만, 과실의 성숙 중에 세포벽에서는 다당체의 분해 또는 변형에 관여하는 효소의 활성도 증가한다(Yoshioka et al., 1992; Orr and Brady, 1993).
복숭아의 과실은 다른 과종에 비해 수확 후부터 과실의 연화가 급격하게 진행되어 보구력이 약한 특징을 지니고 있다. 외국은 물론 국내에서는 복숭아의 보구력을 개선하기 위한 저장 방법 개발 및 처리기술 개발(Oh et al., 1996; Bonghi et al., 1999; Park, 1999; Kim et al., 2003; Chung et al., 2006; Choi and Bae, 2007; Yoo et al., 2018)을 위한 다양한 연구가 진행되어 왔다. 또한, 복숭아에서 훈증용 1-MCP와 에틸렌 흡착제를 이용한 저장성 향상에 관한 연구는 진행되어 왔으나(Dal Cin et al., 2006; Hayama et al., 2008), 1-MCP 및 AVG의 수체 살포에 따른 저장성 향상에 관한 연구는 미비한 실정이다. 따라서 본 연구에서는 ‘마도카’ 품종의 복숭아나무에 1-MCP와AVG를 처리한 후 과실을 수확하고, 상온 및 저온 ‧ 저장 ‧ 기간 ‧ 동안 과실 특성의 변화 양상과 성숙과 관련된 유전자의 발현 양상을 조사함으로써 복숭아의 유통기간 연장에 필요한 정보를 제공하고자 하였다.
재료 및 방법
실험재료
2017년과 2018년에 경상북도 경산시에서 관행 농법으로 재배되는 7년생인 복숭아(‘마도카’, ‘유명’ 공대) 성목을 대상으로 실시하였으며, 시험구 배치는 1주를 1반복으로 완전임의배치 4반복으로 수행하였다. 같은 조건의 나무에 1-MCP 및 AVG를 처리한 후 80% 정도 성숙된 복숭아 과실 중에서 과중 및 착색 정도가 비슷한 과실을 선별, 수확하여 실험재료로 사용하였다.
1-MCP 및 AVG 처리 및 저장
1-MCP(1-Methlycyclopropene, HarvistaTM, 3.8%, AgroFresh Inc, P.A. USA)와 AVG(Amino-ethoxyvinylglycine, Retain, Youngil Chemical, 15% W/W)를 복숭아 나무에 살포하였다. 2017년에는 1-MCP(120, 240mg·L-1)를 수확 전 수확 전 30일부터 7일간격으로 3회 살포하고 AVG(75mg·L-1) 를 수확 전 21일부터 2회 처리하였다. 2018년에는 수확 전 30일부터 1-MCP를 (240mg·L-1)를 3회, 수확 전 21일부터 AVG(75mg·L-1)를 2회, 1-MCP(240mg·L-1) + AVG(75mg·L-1)를 2회 처리하였다. 과실은 유통용 상자에 넣어 한 층으로 유지하여 상온(25°C)과 저온(12°C)에 저장하였다. 수체에서 유지되는 과실과 수확 후의 과실에서의 물질 처리에 의한 유전자 발현 차이를 비교하기 위하여 과실 수확기에 각각 3주의 식물체에 1-MCP(240mg·L-1)와 AVG(75mg·L-1)를 분무처리하고 수확한 과실과, 임의로 수체로부터 수확한 후에 1-MCP(240mg·L-1)와 AVG(75mg·L-1) 를 분무처리한 과실로 구분하여 24시간이 경과한 후 액체질소에서 급속 냉동한 후 ‑80°C에서 보관하였다.
과실 특성 평가
수확한 과실을 상온저장하면서 수확 직후, 2일, 4일, 6일이 경과한 후에, 저온저장중에는 4일, 8일이 경과한 후에 과실 특성의 변화를 조사하였다. 각각 6개의 과실을 대상으로 과중, 경도, 가용성 고형물 함량, 산 함량, 과피색 색도의 특성 변화를 조사하였다. 과실 경도는 계측어댑터의 직경이 11mm인 과실경도계(EST-FG2V, POLYGON, China와 EFG-1000, ENPAIX, China)를 사용하여 복숭아 적도면의 과피를 제거한 후 과실 당 2회 측정한 값을 평균하여 Newton(N)으로 나타냈다. 가용성 고형물 함량은 과즙 1mL을 디지털 당도계(PAL-1, ATAGO, Japan)로 측정하여 °Brix로 나타냈다. 산 함량은 과즙 0.3mL를 증류수 30mL에 희석하고 디지털 과일 산도계(GMK-835N, ㈜GMK, Korea)를 이용하여 %로 나타냈다. 색도는 과실의 봉합선을 기준으로 과실 적도면을 과실 당 3회 색도계(CR-300, MINOLTA, Japan)를 이용하여 측정한 a값(백판 L 93.8, a 0.3130, b 0.3195)을 평균하였다.
Ethylene 및 CO2 발생량 조사
에틸렌 발생량과 호흡량은 저장 중인 과실을 실온(25°C)에서 안정화를 시킨 후 6개의 과실을 대상으로 각각 1L의 용기에 넣어 1시간 동안 밀폐한 후 1mL의 용기 내의 공기를 포집하여 GC(GC-2010, Schmadzu, Japan)를 이용하여 에틸렌 및 이산화탄소의 농도를 측정하였다. 에틸렌 분석 조건은 Sample 양 1mL을 Carrier gas N2(20mL/min)조건에서 Column(SUS ID 2mm x 1m, active alumina 60 ‑ 80mesh 150°C)을 이용하여, Detector는 FID 250°C조건하에 측정되었다. 이산화탄소 분석 조건은 Sample 양 0.5mL을 Carrier gas H2(40mL/min)조건에서 Column(SUS ID 2mm × 1m, active carbon 60 ‑ 80mesh 150°C)을 이용하여, Detector는 TCD 180°C조건하에 측정되었다.
RNA 분리 및 Real-Time PCR
수확 전 수체에 처리한 복숭아와 수확 후 과실에 처리한 복숭아에서 RNA를 분리하였다. 수확 후 바로 과피와 과육을 포함한 두께 1 ‑ 2mm를 액체질소에서 동결시키고 RNA분리까지 ‑80°C에서 보관하여 이용하였다. RNA분리는 와 Chang et al. (1993)와 Hu et al.(2002)의 방법을 이용하였다. Nano Drop spectrophotometer(ND-1000, Technologies Inc., Wilmington, DE, USA)을 이용하여 RNA 정량 후 500mg·mL-1로 희석된 total RNA로부터 GoScriptTM Reverse Transcription System (GoScriptTM Reverse Transcription System, Promega, Madison, USA)를 통해 cDNA를 합성하였고, 이 cDNA를 이용하여 real-time PCR을 수행하였다.
Real-time PCR은 에틸렌 생합성 관련 유전자 PpACO와 PpACS1, 에틸렌 수용체 관련 유전자PpEIN3와 PpERS1, 세포벽 관련 유전자인 PpPG, PpPGL, PpPME, PpLOX1(Table 1)의 프라이머를 이용하였고, SYBR Premix Ex(SYBR Premix Ex Taq, TaKaRa Bio Inc., Osaka, Japan)을 사용하였다. 반응 조건은 95°C에서 30초 95°C에서 5초, 60°C에서 30초의 조건으로 총 40회 반복하였다. Transcript 수치는 복숭아의 Actin gene을 대조구로 사용하여 표준곡선을 통해 나타냈으며 이 수치를 유전자 발현 값 분석 data로 이용하였다.
Table 1. NCBI accession numbers from NCBI and primer nucleotide sequences of genes used for real-time PCR analysis in this study
통계처리
통계분석은 SPSS프로그램(IBM SPSS Statistics 20, SPSS Inc., USA)으로 분산분석을 실시하였고 실험처리 평균치 간의 유의성은 Duncan’s multiple ranges test(p < 0.05)으로 검정하였다.
결과 및 고찰
처리에 따른 저장 중 과실 특성 변화
중생종 품종인 ‘마도카’ 복숭아 과실을 대상으로 에틸렌의 작용과 에틸렌 생합성을 억제하는 기능을 나타내는 1-MCP와 AVG를 수확 3주 전부터 단용 및 혼용으로 수체에서 처리한 후, 저장 중에 복숭아 과실의 특성변화를 조사하였다.
2017년과 2018년에 처리한 과실을 상온(Table 2)과 저온(Table 3)에서 저장하였을 때 저장 중에 가용성 고형물 함량 및 산 함량, 색도 등의 과실 특성에는 처리간 차이가 나타나지 않았다.
Table 2. Fruit characteristics of 'Madoka' peaches stored at ambient temperature after pre-harvest treatment of trees with 1-MCP and AVG
Table 3. Fruit characteristics of 'Madoka' peaches stored at low temperature after pre-harvest treatment of trees with 1-MCP and AVG
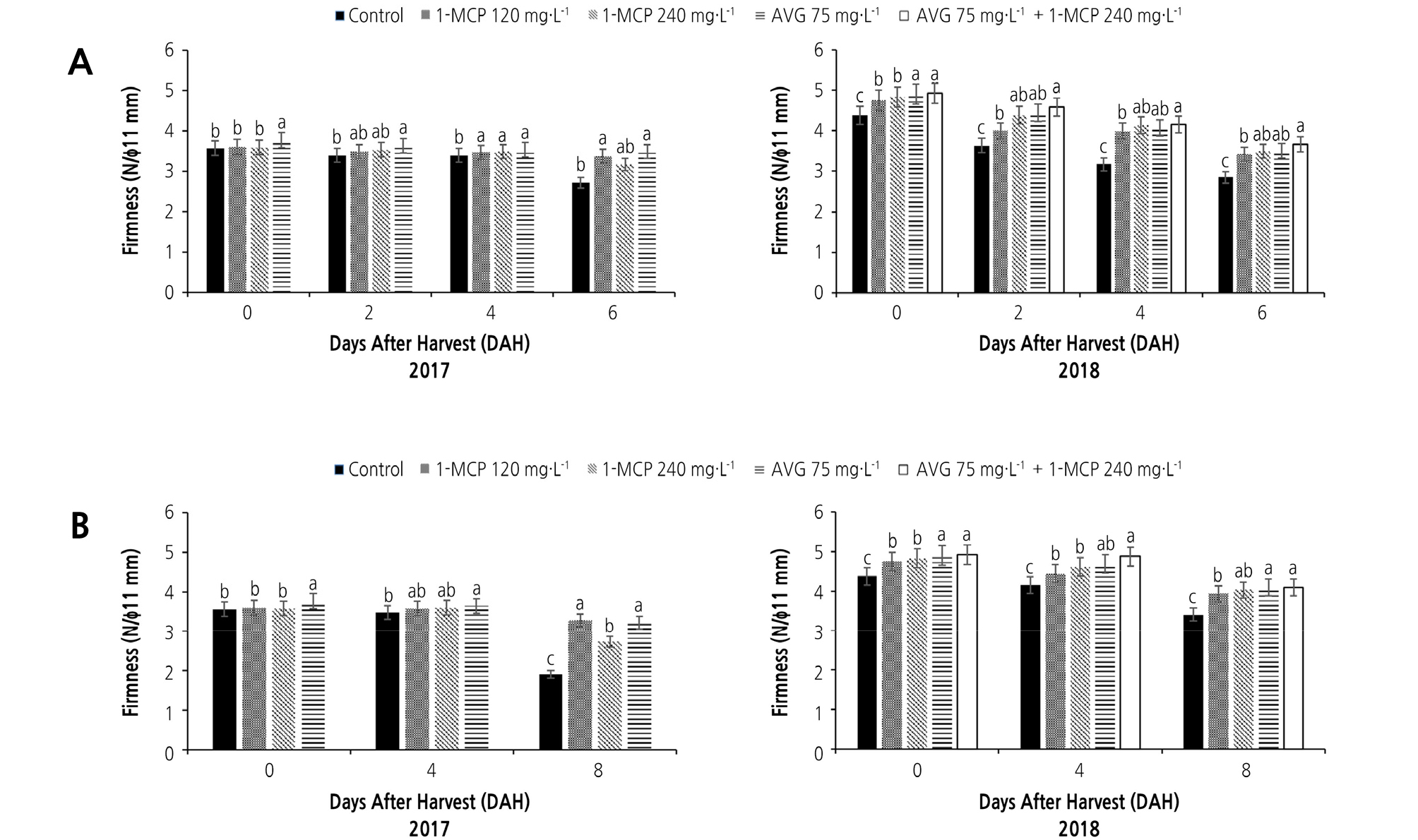
저장 중 과실의 경도 변화는 기간이 경과하면서 처리 간에 차이가 나타났다. 상온 저장 시, 6일이 경과하면서 무처리구에 비해 1-MCP 또는 AVG를 처리한 과실에서 경도의 저하가 억제되었고 저온 저장 중에는 8일 이후부터 1-MCP 또는 AVG를 처리한 과실에서 경도가 높게 유지되었다. 또한 2018년도에는 1-MCP와 AVG를 혼용 처리한 과실에서의 특성 변화는 AVG 단용처리에 비해 유의성이 있는 차이는 나타나지 않았다(Fig. 1).
저장 중인 사과 과실에 훈증용 1-MCP 처리를 하면 과실의 경도는 높게 유지되고 가용성 고형물 함량은 변화가 없는 것으로 보고되었다(Rupasinghe et al., 2000; Watkins et al., 2000, 2005; Lim et al., 2007; Park et al., 2009; Park et al., 2012). 수확 후에 1-MCP를 처리하면 복숭아 과실로부터의 에틸렌 발생이 억제되고 복숭아의 저장 기간이 연장된다고 보고되어 있다(Kluge and Jacomino, 2002; Choi, 2005). 수체상에서의 AVG 처리에 의해 천도복숭아의 성숙을 지연시키고 저장력을 향상시키는 것으로 보고되어 있다(McGlasson et al., 2005). 1-MCP와 AVG가 에틸렌 발생량을 감소시켜 유기산이 호흡 기질로 전환되는 것을 억제하여 과실의 품질 또한 유지하는데 효과적인 것으로 알려져 있다(Rupasinghe et al., 2000; Toivonen and Lu, 2005). 수체 살포용인 1-MCP와 AVG은 에틸렌 작용억제와 생합성 억제를 통해 과실의 품질을 유지하는데 효과적이라고 알려져 있다(Watkins et al., 2004; Watkins and Nock, 2005; Park et al., 2009; Yoo and Kang, 2013). 본연구에서는 1-MCP와 AVG의 수체 처리에 의해 복숭아 과실의 가용성 고형물 함량 및 산 함량, 색도 등의 과실 특성은 처리 간의 차이가 없었으며, 저장 중 과실의 경도 변화는 기간이 경과하면서 처리 간에 차이가 나타났다. 이는 기존의 연구 결과와 같이 1-MCP와 AVG의 처리에 의해 과실의 에틸렌 합성과 작용을 억제하여 경도를 유지한 때문으로 여겨진다.
Ethylene 과 CO2 발생량 변화
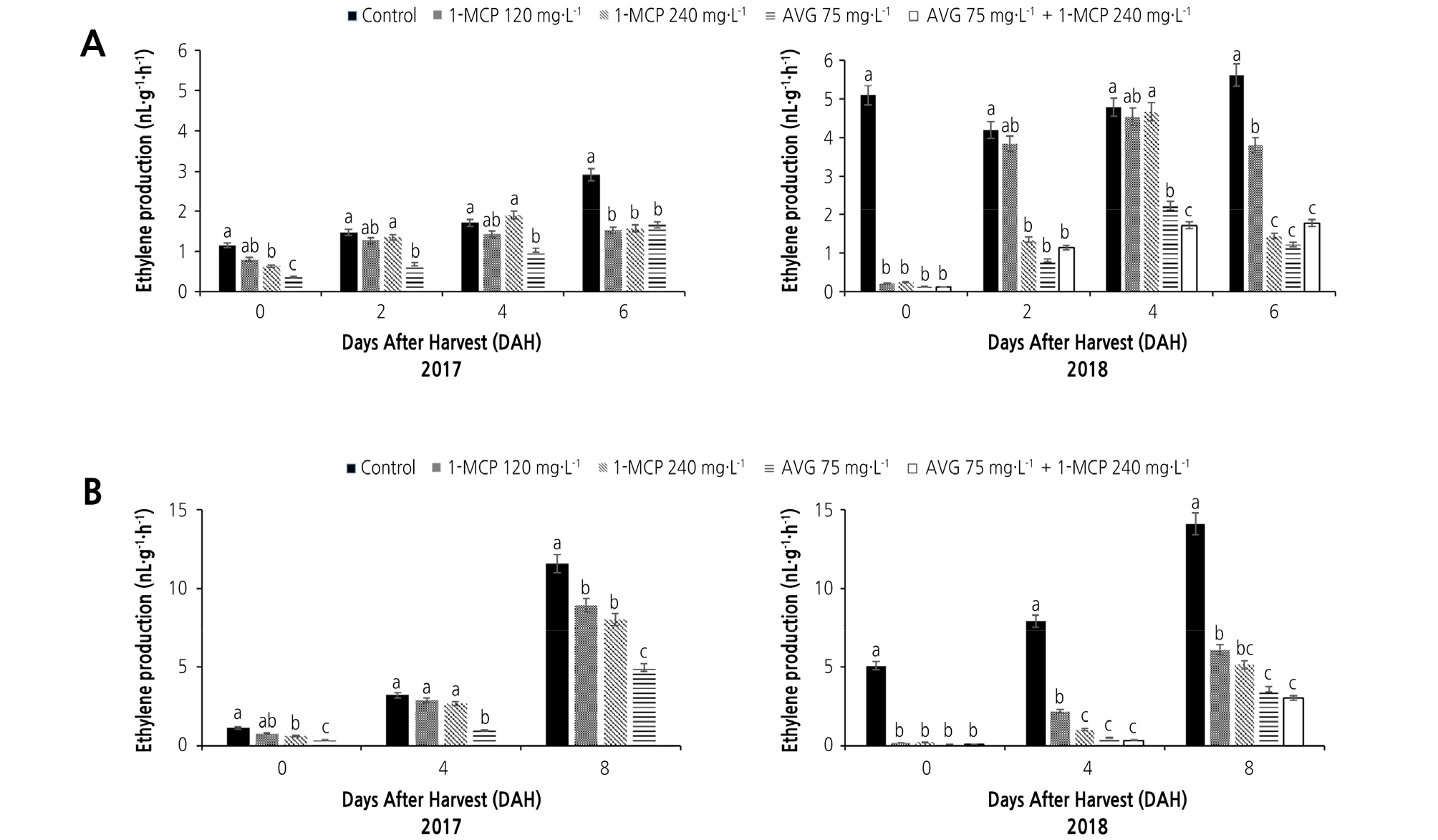
수확 전에 수체상에서 1-MCP와 AVG를 처리한 후 복숭아 과실을 대상으로 저장 기간에 에틸렌 발생과 호흡의 변화를 조사하였다. 에틸렌의 발생은 수확 직후에도 무처리구에 비해 1-MCP와 AVG를 처리한 과실에서 현저하게 낮았다. 에틸렌 발생은 상온 저장과 저온저장 조건에서 모두 저장 일수가 경과함에 따라 무처리구에서 가장 높았으며 1-MCP와 AVG를 처리한 모든 과실에서 낮게 나타났다. 그 중에서 AVG의 단용 처리한 과실과 AVG와1-MCP를 혼용 처리한 과실에서 에틸렌 발생이 현저하게 낮았다(Fig. 2).
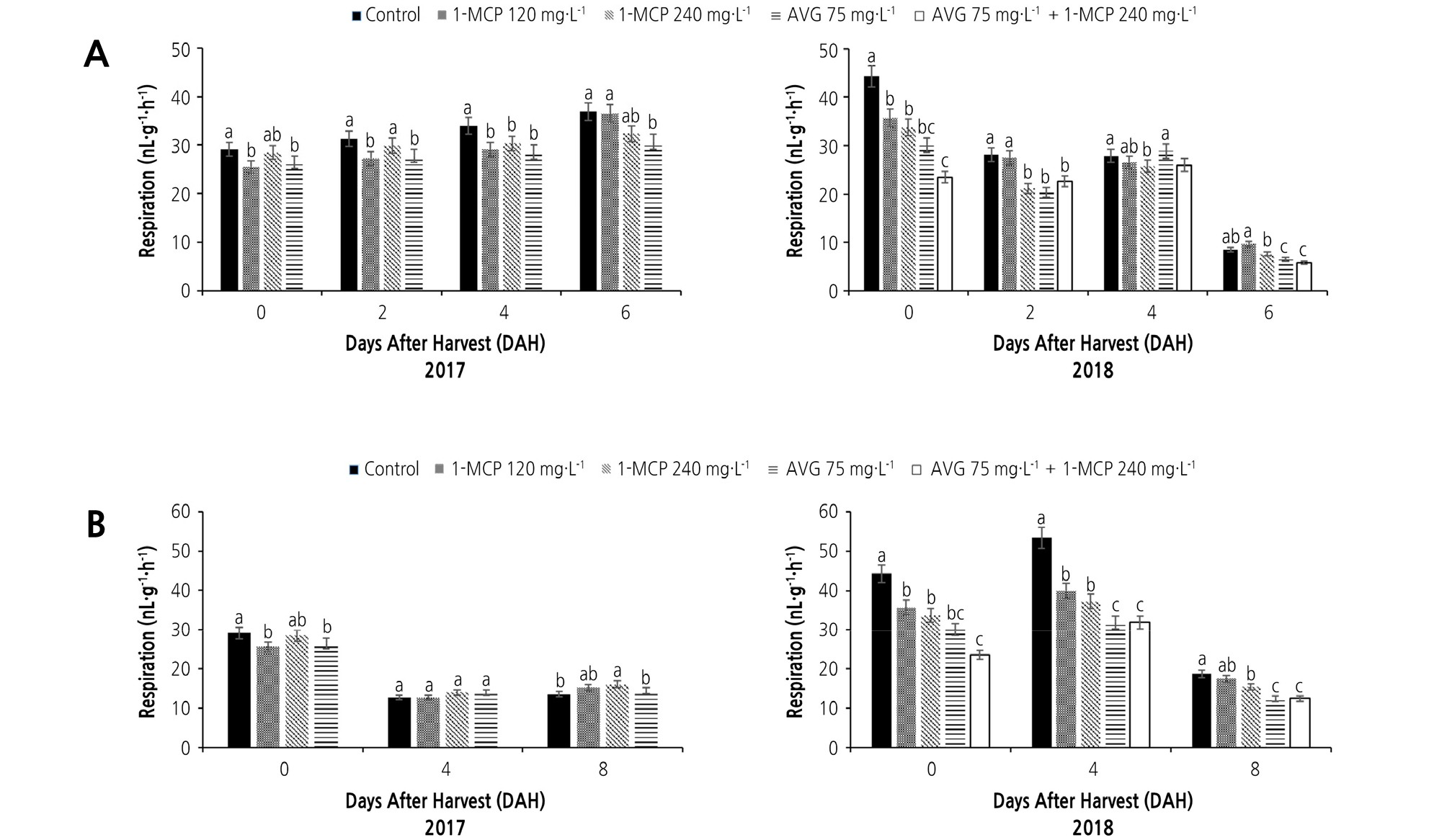
1-MCP와 AVG를 처리한 과실에서 호흡의 변화를 조사한 결과, 호흡은 저장 일 수가 경과함에 따라 상온 저장과 저온 저장 중인 과실에서 에틸렌 발생량과 마찬가지로 1-MCP와 AVG 처리에 의해 호흡이 억제되었다. 상온에서는 처리 간 큰 차이를 보이지 않았지만 통계상 유의성이 인정되었고, 무처리구에 비해 AVG 단용처리구에서 호흡 감소가 확인되었다(Fig. 3A). 2018년도의 실험에서 복숭아 과실의 후숙이 진행되면서 호흡의 감소가 진행되었으며 저장 6일차에 호흡이 급격하게 감소하였는데 이는 2017년도 과실에 비해 성숙이 더 진행된 과실이 분석에 사용되었기 때문으로 여겨진다.
저온에서 저장 중인 과실에서의 호흡 변화는 상온저장에 비해 대체로 적었으며, 저온에서 저장 중인 과실의 호흡 변화는 처리 간에 차이를 나타내었다(Fig. 3B). 특히 2018년도의 실험에서는 시간이 경과하면서 모든 처리구에서 이산화탄소 생성량이 감소하였으며, 수확 직후에도 무처리구에 비해 처리구에서 이산화탄소 생성량이 감소하였다. 그러나 상온 저장 중인 과실에서 6일과 저온 저장중 과실에서 8일이 경과하면 호흡이 감소하는 경향을 보이는데, 이는 과실이 더 이상 성숙이 진행되지 않아 호흡이 감소한 것으로 생각된다.
복숭아는 수확 후 과실 저장 중에 성숙을 촉진하는 에틸렌 발생을 억제함으로써 저장기간을 연장할 수 있다고 보고되어 있다(Tonutti et al., 1991, 1996; Lelièvre et al.,1997; Hayama et al., 2006). 사과와 복숭아 등의 호흡급등형 과실에 1-MCP를 훈증 처리하여 에틸렌 및 이산화탄소의 발생량을 억제하여 품질을 유지할 수 있다고 보고되어 있다(Lim et al., 2007; Yuan and Li, 2008; Park and Yoon, 2012). 에틸렌 발생을 억제하기 위한 1-MCP 처리는 복숭아 경도에 미치는 영향은 미비하나 에틸렌 작용 및 호흡 발생을 억제함으로써 과실의 품질을 유지하는데 효과적이다(Liguori et al., 2004; Choi and Bae, 2007; Seo et al., 2007). 에틸렌 생합성 억제 물질인 AVG를 과실에 침지 처리하여도 저장기간을 연장하는 데 효과적인 것으로 보고되어 있다(Garner et al., 2001; Hayama et al., 2006, 2008).
1-MCP와 AVG를 수확 전 수체에 살포하였을 때 저장 중 사과 과실의 에틸렌 발생 및 호흡량을 감소시켜 경도를 높게 유지하며 과실의 연화를 지연시키는데 도움을 준다(Moran and McManus, 2005; Yoo et al., 2018).
사과에서 보고된 바와 마찬가지로 본 연구에서는 수확 전에 ‘마도카’ 복숭아 품종의 수체에 1-MCP와 AVG를 처리하면, 수확 후 과실의 저장 중에 에틸렌의 발생과 이산화탄소 발생을 억제하여 저장 기간의 연장 효과가 나타난 것으로 사료된다.
과실 성숙 및 에틸렌 합성 관련 유전자 발현 분석
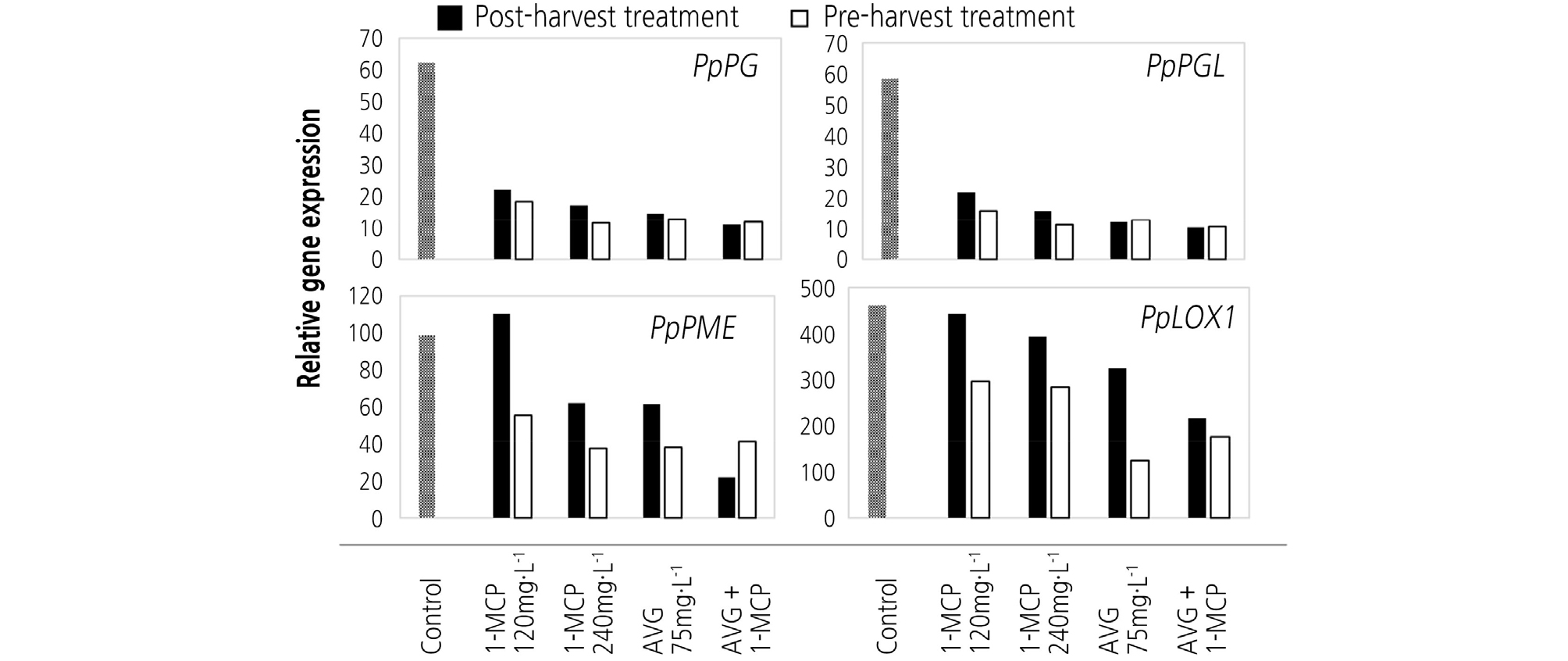
수확 전 수체처리와 수확 후 처리를 구분하여 1-MCP와 AVG를 과실에 처리한 후 24시간이 경과한 복숭아 과실에서 과실의 성숙과 관련된 유전자 발현을 조사하였다. 수확 전 수체에서 처리한 과실에서 당대사에 관여하는 효소인 polygalacturonase 유전자(PpPG, PpPGL)의 발현이 크게 억제되었다(Fig. 4). 과실의 펙틴 분해와 관련이 있는 PpPME 유전자 발현도 1-MCP 및 AVG 처리에 의해 억제되었으며 수체에 처리한 과실에서 대체로 적게 나타났다. 과실의 성숙이 진행되면서 발현이 증가하는 것으로 알려진 PpLOX1는 1-MCP 및 AVG 처리 간 유의한 차이를 보였고, 수확 후 처리 보다 수체에 수확 전에 처리한 과실에서 발현이 억제되었다. 또한 AVG 또는 1-MCP의 단용처리에서 유전자의 발현이 억제되었다.
1-MCP와 AVG를 처리한 후 24시간이 경과한 복숭아에서 과실의 성숙과정에서 에틸렌의 대사에 관여하는 4개의 유전자 발현 차이를 비교하였다. 1-Aminopropane-1-carboxylic acid(ACC) oxidase 유전자(PpACO)는 수확 전에 1-MCP(240mg·mL-1)를 처리한 과실에서 발현이 크게 억제되었으며 수확 후에 처리한 과실에서는 1-MCP와 AVG를 처리한 과실에서 발현이 억제되었다(Fig. 5). ACC synthase 유전자(PpACS1)는 수확 후에 처리한 모든 처리구 과실에서 발현이 크게 억제되었으며 수체에 처리한 모든 과실에서는 대체로 유전자의 발현이 낮게 유지되었다. 수확 후 과실에 1-MCP(120mg·L-1, 240mg·L-1)를 처리한 경우 PpACS1의 발현이 높게 나타났으나, AVG + 1-MCP 처리한 과실에서는 낮게 유지되어 처리 물질에 따른 차이가 있음을 알 수 있었다.
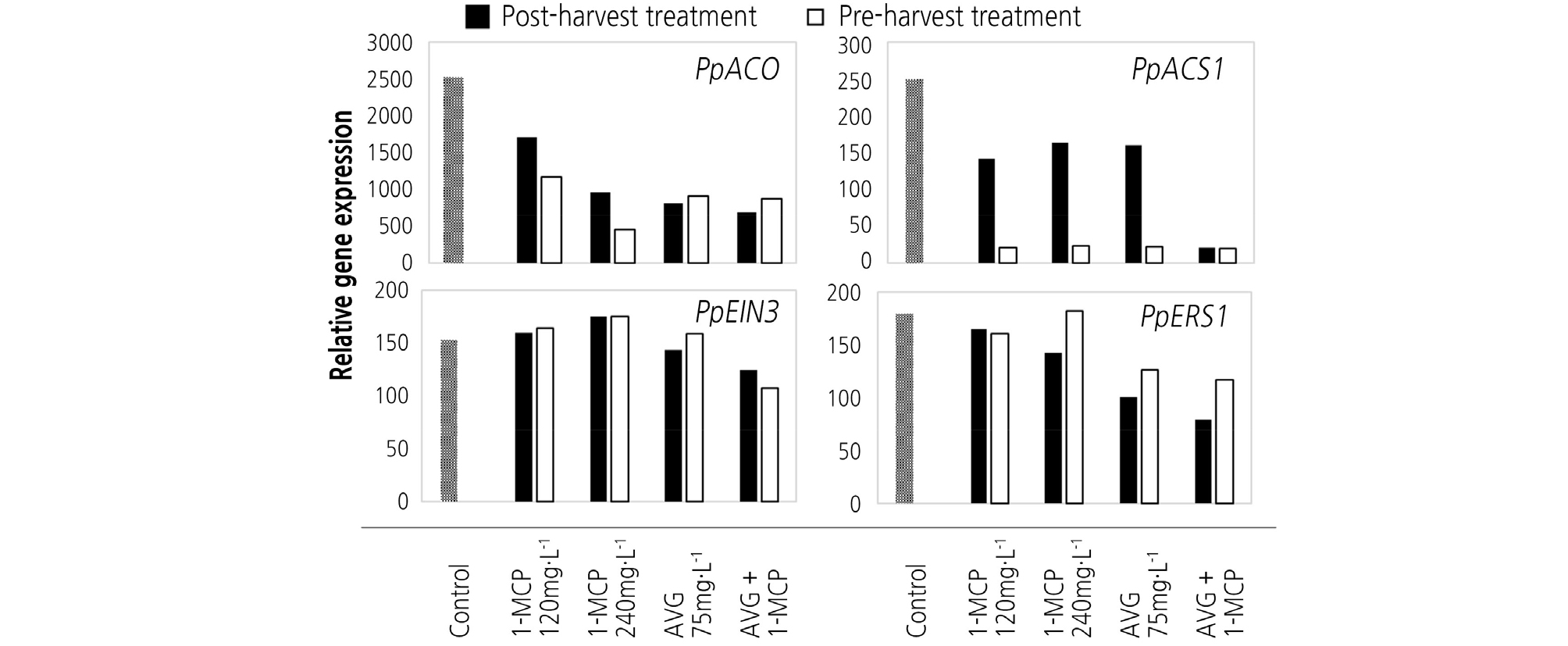
Fig. 5.
Expression of ethylene-related genes PpACO, PpACS1, PpEIN3, and PpERS1 in ‘Madoka’ peach fruits after pre- harvest treament and post-harvest treatment of plants with several ethylene inhibiting chemicals. ACO; 1-aminopropane 1-carboxylic acid (ACC) oxidase, ACS1; ACC synthase 1, EIN3; ethylene insensitive protein 3, ERS1; ethylene response sensor 1.
또한 에틸렌 수용체의 대사와 관련이 있는 ethylene insensitive protein 3 유전자(PpEIN3)와 ethylene response sensor 1 유전자(PpERS1)의 발현이 PpACO와 마찬가지로 수확 후에 1-MCP와 AVG를 처리한 과실에서 낮게 나타났다.
복숭아는 과실 성숙이 진행되면서 당함량 증가가 수반되며 당대사에서 다당류를 이당류 또는 단당류로 분해해서 당도 향상에 관여하는 효소의 유전자인 PpPG와 PpPGL의 발현이 유도된다(Orr and Brady, 1993; Hegde and Maness, 1996; Byun et al., 2003; Brummell et al., 2004). 또한 복숭아는 과실 성숙이 진행되면서 세포벽 연화에 관여하는 효소도 함께 증가하는 것으로 보고되어 있다(Hobson, 1981; Fischer and Bennett, 1991; Chang et al., 1999; Chun and Kim, 2013). 1-MCP와 AVG의 수체 처리에 의해서 복숭아 과실의 PpPG와 PpPGL유전자 발현이 감소하였으며, 과실 세포의 구조 변화에 관여하는 효소 유전자인 PpPME의 발현도 억제되었다. 이러한 1-MCP와 AVG의 수체 처리에 따른 유전자의 발현 억제는 저장 중에 성숙의 진행이 지연되어 저장력의 향상에 기여한 것으로 여겨진다.
과실의 숙성과정에서 에틸렌 생합성 조절은 주로 ACC synthase와 ACC oxidase에 의해 조절된다(Kende, 1993; Wang et al., 2002; Yuan et al., 2010). 복숭아의 숙성 과정에서 PpACO 와 PpACS1유전자 발현 정도가 에틸렌 생합성에 중요하게 연관된다고 보고되어 있다(Tonutti et al., 1996; Mathooko et al., 2001). 본연구에서는 1-MCP와 AVG처리에 의해서 복숭아 과실에서 경도가 높게 유지되었으며 동일한 처리구의 과실에서 PpACO 와 PpACS1유전자 발현이 억제되는 결과를 얻었다. 이러한 결과는 복숭아에서 1-MCP와 AVG처리에 의해 과실 성숙에 관여하는 PpACO 와 PpACS1유전자 발현이 억제됨으로써 과실의 성숙과 연화를 억제하는 것을 의미한다고 할 수 있다. 과실이 성숙하는 동안 에틸렌 생합성이 진행되면서 에틸렌 수용체의 발현 증가가 수반되는 것으로 알려져 있다(Klee, 2004; Dal Cin et al, 2006; Kevany et al., 2007). 본 연구에서는 1-MCP 또는 AVG처리에 의해 에틸렌 수용체인 PpEIN3, PpERS1유전자는 PpACO,PpACS1와 마찬가지로 수확 후 과실에 1-MCP와 AVG 를 처리하였을 때 유전자가 낮게 발현되어 에틸렌 생합성 및 작용이 억제되었음을 추정할 수 있다.
본 연구에서는 우리나라에서 재배되는 주요 복숭아인 ‘마도카’ 품종의 수체에 1-MCP와 AVG를 분무하고 수확하여 상온과 저온 저장 중 과실 특성 변화를 조사하였다. 수체에서 1-MCP와 AVG를 처리한 결과, 복숭아 과실의 가용성 고형물 함량 및 산 함량, 색도 등의 과실 특성에는 처리 간 차이가 나타나지 않았으며, 저장 중 과실의 경도 변화는 기간이 경과하면서 처리 간 차이가 나타났다. 에틸렌 발생은 수확 직후의 과실과 저장 중인 과실에서 1-MCP와 AVG 처리에 의해 현저하게 낮아졌다. 시간이 경과하면서 모든 처리구에서 호흡률이 감소하였다. 또한 당대사, 세포벽 연화와 관련된 유전자는 물론 에틸렌 생합성과 수용체의 반응에 관여하는 유전자의 발현이 억제되었다. 결과적으로 1-MCP와 AVG 의 수체 처리에 의해 저장 중인 과실의 에틸렌 합성과 호흡률의 감소를 유도하여 저장기간 연장효과가 나타난 것으로 여겨진다. 이러한 결과는 향후 복숭아의 보구력 향상 및 저장 기간 연장을 위한 기술 개발에 중요한 정보를 제공하고 복숭아의 소비 촉진과 해외 수출 확대에도 도움이 될 것으로 여겨진다.